材料与方法
一、材 料
1. 菌株来源
2. 主要仪器及试剂
二、方 法
1. 药物敏感试验及数据分析
2. β-内酰胺酶表型检测
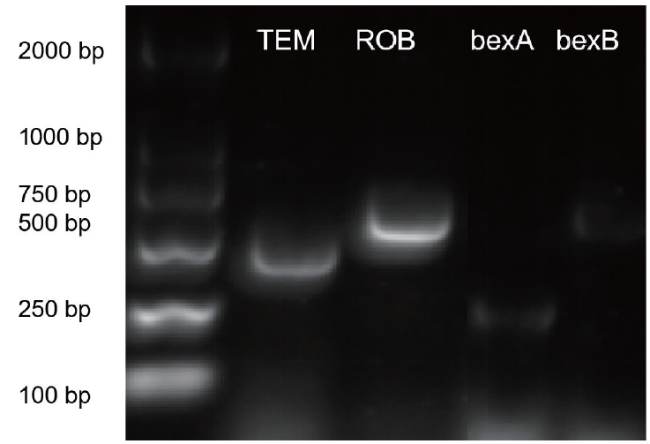
3. 耐药基因PCR检测
3.1 引物合成
表1 PCR扩增引物序列 |
| 基因名称 | 引物序列 | 产物长度(bp) | 退火温度 |
|---|---|---|---|
| TEM | 正向:5’-TGGGTGCACGAGTGGGTTAC-3’ | 526 | 57℃ |
| 反向:5’-TTATCCGCCTCCATCCAGTC-3’ | |||
| ROB | 正向:5’-ATCAGCCACACAAGCCACCT-3’ | 692 | 62℃ |
| 反向:5’-GTTTGCGATTTGGTATGCGA-3’ | |||
| bexA | 正向:5’-CGTTTGTATGATGTTGATCCAGAC-3’ | 567 | 54℃ |
| 反向:5’-TGTCCATGTCTTCAAAATGATG-3’ | |||
| bexB | 正向:5’-GGTGATTAACGCGTTGCTTATGCG-3’ | 343 | 54℃ |
| 反向:5’-TTGTGCCTGTGCTGGAAGGTTATG-3’ | |||
| a | 正向:5’-CTACTCATTGCAGCATTTGC-3’ | 250 | 60℃ |
| 反向:5’-GAATATGACCTGATCTTCTG-3’ | |||
| b | 正向:5’-GCGAAAGTGAACTCTTATCTCTC-3’ | 480 | 60℃ |
| 反向:5’-GCTTACGCTTCTATCTCGGTGAA-3’ | |||
| c | 正向:5’-TCTGTGTAGATGATGGTTCA-3’ | 250 | 60℃ |
| 反向:5’-CAGAGGCAAGCTATTAGTGA-3’ | |||
| d | 正向:5’-TGATGACCGATACAACCTGT-3’ | 150 | 60℃ |
| 反向:5’-TCCACTCTTCAAACCATTCT-3’ | |||
| e | 正向:5’-GGTAACGAATGTAGTGGTAG-3’ | 1350 | 60℃ |
| 反向:5’-GCTTTACTGTATAAGTCTAG-3’ | |||
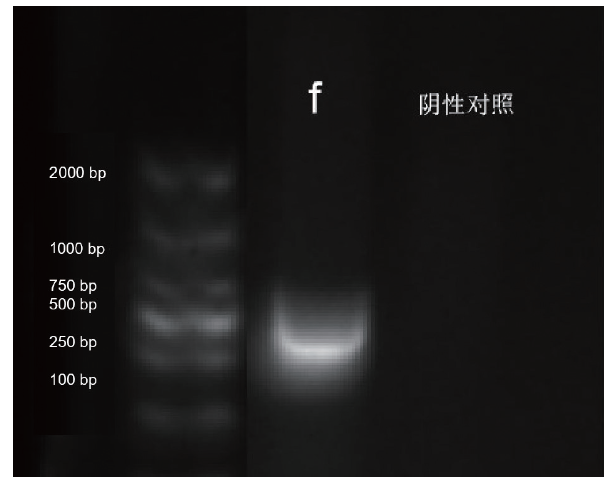
| f | 正向:5’-GCTACTATCAAGTCCAAATC-3’ | 450 | 60℃ |
| 反向:5’-CGCAATTATGGAAGAAAGCT-3’ |
3.2 模板制备
3.3 PCR反应体系
3.4 耐药基因扩增条件
3.5 荚膜分型扩增条件
3.6 PCR产物电泳
三、统计学处理
结 果
一、菌株标本来源
二、流感嗜血杆菌抗菌药物耐药性
表2 107株流感嗜血杆菌对8种抗菌药物耐药性 株数(%) |
| 抗菌药物 | 耐药 | 中介 | 敏感 |
|---|---|---|---|
| 氨苄西林/舒巴坦 | 49(45.8) | 1(0.9) | 57(53.3) |
| 氯霉素 | 11(10.3) | 4(3.7) | 92(86.0) |
| 氨苄西林 | 82(76.6) | 4(3.7) | 21(19.6) |
| 美罗培南 | 0 | 0 | 107(100) |
| 头孢噻肟 | 10(9.3)a | 0 | 97(90.7) |
| 头孢呋辛 | 44(41.1) | 5(4.7) | 58(54.2) |
| 复方磺胺甲 口 恶 唑 | 73(68.2) | 2(1.9) | 32(29.9) |
| 左氧氟沙星 | 5(4.7)a | 0 | 102(95.3) |
注:a为非敏感率 |
三、成人与未成年人流感嗜血杆菌的耐药性比较
表3 成人与未成年人流感嗜血杆菌对8种抗菌药物耐药性比较 |
| 抗菌药物 | 耐药率(%) | $\chi^{2}$值 | P值 | |
|---|---|---|---|---|
| 未成年人组 (n = 41) | 成人组 (n = 66) | |||
| 氨苄西林/舒巴坦 | 43.9 | 47.0 | 0.100 | 0.760 |
| 氯霉素 | 4.9 | 13.6 | 0.479b | 0.489 |
| 氨苄西林 | 85.4 | 71.2 | 2.830 | 0.090 |
| 美罗培南 | 0 | 0 | - | - |
| 头孢噻肟 | 2.4a | 1.5a | 0.178b | 0.673 |
| 头孢呋辛 | 34.2 | 45.5 | 1.340 | 0.250 |
| 复方磺胺甲 口 恶 唑 | 73.2 | 65.2 | 0.750 | 0.390 |
| 左氧氟沙星 | 2.4a | 1.5 | 0.178b | 0.673 |
注:a为非敏感率;b校正$\chi$2检验 |
四、产酶株与不产酶株药物耐药性比较
表4 产酶株与不产酶株药物耐药性比较 |
| 抗菌药物 | 耐药率(%) | $\chi$2值 | P值 | |
|---|---|---|---|---|
| β-内酰胺酶(+) (n = 72) | β-内酰胺酶(-) (n = 35) | |||
| 氨苄西林/舒巴坦 | 55.6 | 20 | 12.090 | <0.001 |
| 氯霉素 | 11.1 | 8.6 | 0.004b | 0.947 |
| 氨苄西林 | 100 | 22.9 | 74.290 | <0.001 |
| 美罗培南 | 0 | 0 | - | - |
| 头孢噻肟 | 1.4a | 2.9a | - | 1.000c |
| 头孢呋辛 | 43.1 | 31.4 | 1.340 | 0.250 |
| 复方磺胺甲 口 恶 唑 | 69.4 | 60 | 0.940 | 0.330 |
| 左氧氟沙星 | 2.78a | 0 | - | 1.000c |
注:a为非敏感率,b校正$\chi$2检验,c Fisher确切概率法 |