材料与方法
一、材料
二、试剂与仪器
三、研究方法
四、统计学处理
结果
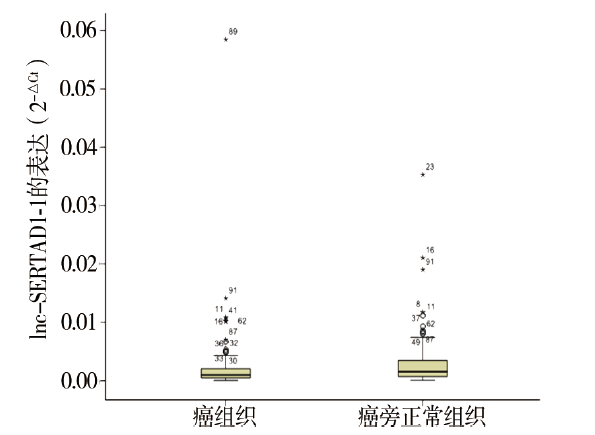
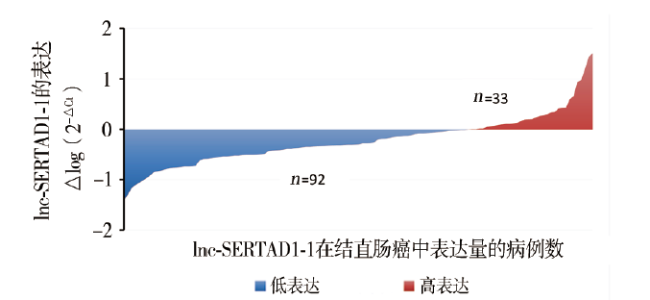
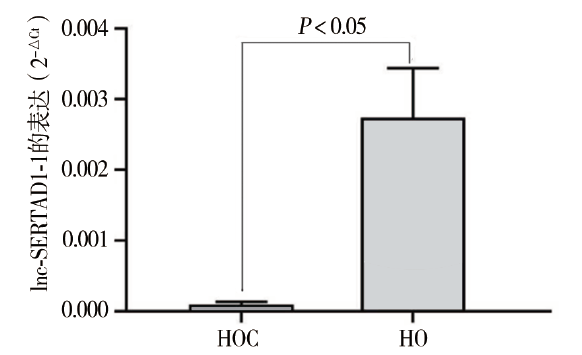
一、lnc-SERTAD1-1在癌组织与癌旁正常组织中的表达水平
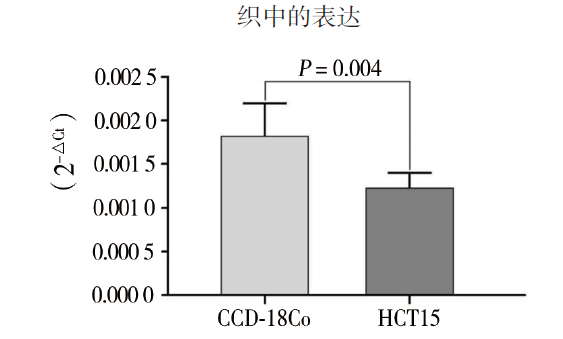
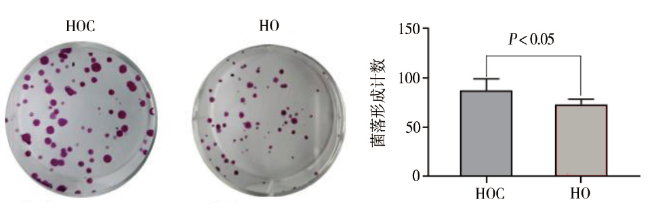
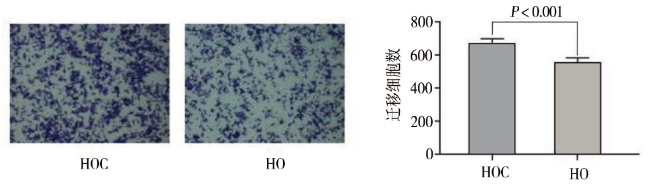
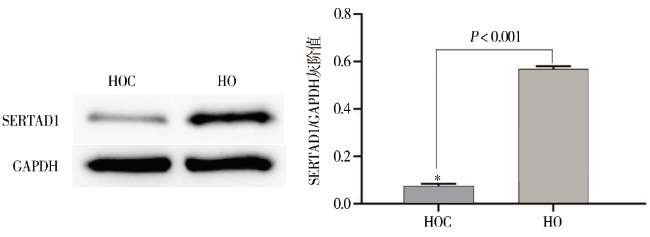
二、lnc-SERTAD1-1在CCD-18Co与HCT15中的表达
三、lnc-SERTAD1-1的表达与结直肠癌临床病理特征的关系
表1 125例结直肠癌患者临床病理特征与lnc-SERTAD1-1表达的关系[例(%)] |
| 临床病理因素 | 例数 | 低表达样本(62例) | 高表达样本(63例) | x2值 | P值 |
|---|---|---|---|---|---|
| 性别 | 2.379 | 0.123 | |||
| 男 | 70 | 39(55.7) | 31(44.3) | ||
| 女 | 55 | 23(41.8) | 32(58.2) | ||
| 年龄 | 1.151 | 0.562 | |||
| < 50岁 | 18 | 8(44.4) | 10(55.6) | ||
| 50 ~ 60岁 | 35 | 20(57.1) | 15(42.9) | ||
| > 60岁 | 72 | 34(47.2) | 38(52.8) | ||
| 肿瘤部位 | 6.350 | 0.042 | |||
| 直肠 | 72 | 42(58.3) | 30(41.7) | ||
| 左半结肠 | 32 | 14(43.8) | 18(56.2) | ||
| 右半结肠 | 21 | 6(28.6) | 15(71.4) | ||
| 肿瘤直径 | 4.419 | 0.036 | |||
| < 5 cm | 73 | 42(57.5) | 31(42.5) | ||
| ≥5 cm | 52 | 20(38.5) | 32(61.5) | ||
| 肿瘤分化程度 | 2.098 | 0.350 | |||
| 高 | 21 | 13(61.9) | 8(38.1) | ||
| 中 | 93 | 45(48.4) | 48(51.6) | ||
| 低 | 11 | 4(36.4) | 7(64.6) | ||
| 肿瘤大体分型 | 8.060 | 0.018 | |||
| 肿块型 | 51 | 33(64.7) | 18(36.3) | ||
| 环窄型 | 12 | 4(33.3) | 8(66.7) | ||
| 溃疡型 | 62 | 25(40.3) | 37(59.7) | ||
| 淋巴结转移 | 2.305 | 0.129 | |||
| 无 | 67 | 29(43.3) | 38(56.7) | ||
| 有 | 58 | 33(56.9) | 25(43.1) | ||
| 肿瘤浸润深度 | 2.237 | 0.135 | |||
| 黏膜+肌层 | 13 | 9(69.2) | 4(30.8) | ||
| 全层 | 112 | 53(47.3) | 59(52.7) |
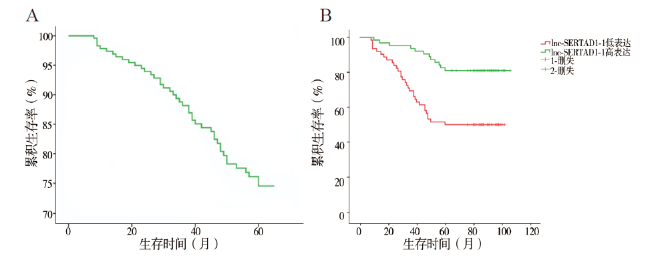
四、结直肠癌患者不同临床病理特征与生存率的多因素分析
表2 125例结直肠癌患者OS及DFS的多因素Cox分析 |
| 项 目 | OS | DFS | ||||
|---|---|---|---|---|---|---|
| B | HR(95% CI) | P值 | B | HR(95% CI) | P值 | |
| 性别 | ||||||
| 男 | 1.000 | 1.000 | ||||
| 女 | -0.037 | 0.964(0.500 ~ 1.859) | 0.913 | -0.186 | 0.830(0.409 ~ 1.686) | 0.607 |
| 年龄 | 0.047 | 0.900 | ||||
| < 50岁 | 1.000 | 1.000 | ||||
| 50 ~ 60岁 | 1.265 | 3.545(0.968 ~ 12.977) | 0.056 | -0.086 | 0.917(0.290 ~ 2.897) | 0.883 |
| > 60岁 | 1.572 | 4.815(1.376 ~ 16.848) | 0.014 | 0.105 | 1.111(0.367 ~ 3.360) | 0.853 |
| 肿瘤部位 | 0.251 | 0.143 | ||||
| 直肠 | 1.000 | 1.000 | ||||
| 左半结肠 | -0.058 | 0.943(0.425 ~ 2.093) | 0.886 | -0.369 | 0.691(0.263 ~ 1.816) | 0.454 |
| 右半结肠 | -0.973 | 0.378(0.120 ~ 1.193) | 0.097 | -1.111 | 0.329(0.105 ~ 1.028) | 0.056 |
| 肿瘤直径 | ||||||
| < 5 cm | 1.000 | 1.000 | ||||
| ≥5 cm | 0.588 | 1.800(0.883 ~ 3.669) | 0.106 | 0.587 | 1.798(0.797 ~ 4.057) | 0.157 |
| 肿瘤分化程度 | 0.361 | 0.503 | ||||
| 高 | 1.000 | 1.000 | ||||
| 中 | 0.194 | 1.214(0.511 ~ 2.885) | 0.661 | 0.625 | 1.867(0.657 ~ 5.305) | 0.241 |
| 低 | -1.272 | 0.280(0.033 ~ 2.372) | 0.243 | -12.570 | 0.000(0.000 ~ 3.662) | 0.970 |
| 肿瘤大体分型 | 0.032 | 0.006 | ||||
| 肿块型 | 1.000 | 1.000 | ||||
| 环窄型 | 1.620 | 5.054(1.503 ~ 16.989) | 0.009 | 1.958 | 7.088(2.129 ~ 23.601) | 0.001 |
| 溃疡型 | 0.532 | 1.703(0.780 ~ 3.715) | 0.181 | 0.477 | 1.611(0.701 ~ 3.703) | 0.261 |
| TNM分期 | ||||||
| Ⅰ ~ Ⅱ | 1.000 | 1.000 | ||||
| Ⅲ ~ Ⅳ | 1.190 | 3.286(1.644 ~ 6.572) | 0.001 | 0.910 | 2.484(1.207 ~ 5.115) | 0.014 |
| lnc-SERTAD1-1表达 | ||||||
| < 0.000 970 | 1.000 | 1.000 | ||||
| ≥0.000 970 | -1.481 | 0.228(0.107 ~ 0.485) | < 0.001 | -1.478 | 0.228(0.103 ~ 0.506) | < 0.001 |