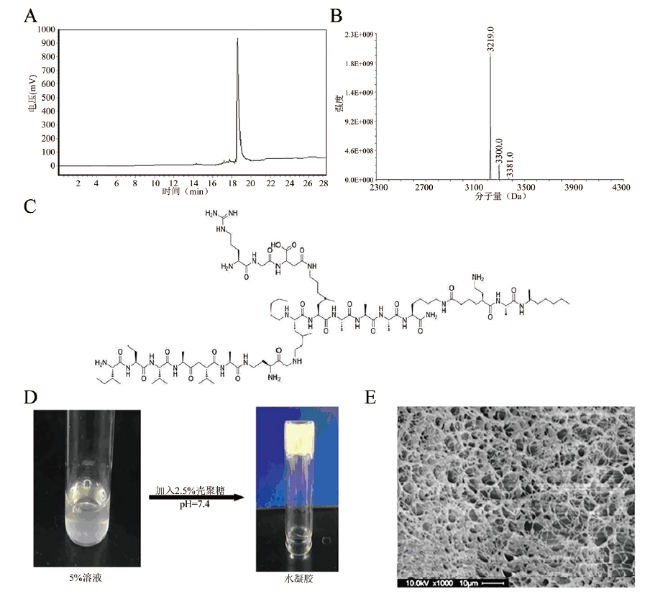
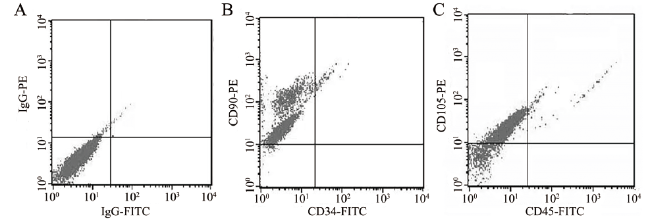
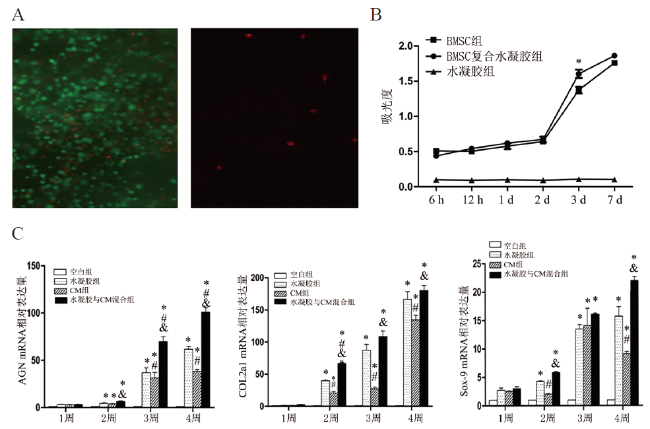
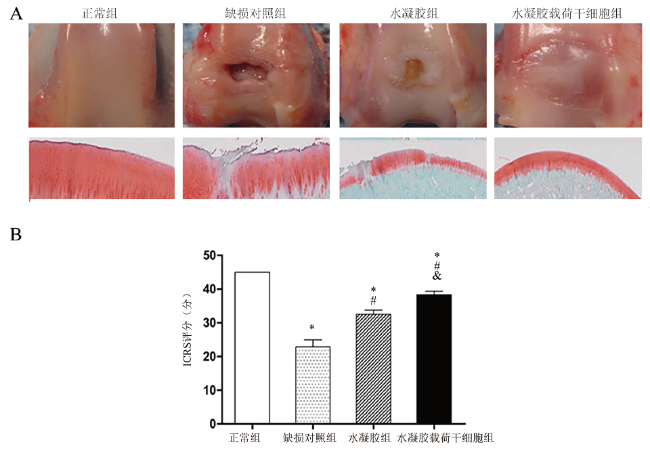
材料与方法
一、实验动物
二、主要材料和仪器
三、方法
表1 引物序列 |
| 基 因 | 序 列 |
|---|---|
| β-actin | 上游5'-CCTCGCCTTTGCCGATCCGC-3' 下游5'-CCACCATCACGCCCTGGTGC-3' |
| AGN | 上游5'-AGTATCATCAGTCCCAGAATCTAGCA-3' 下游5'-AATGCAGAGGTGGTTTCACTCA-3' |
| COL2a1 | 上游5'-ACTGGGACTGTCCTCTGCGACG-3' 下游5'-TCTGTCCCTTTGGTCCTGGTTGC-3' |
| Sox-9 | 上游5'-CTCGGACACCGAGAACACGCG-3' 下游5'-CAGAAGTCTCCAGAGCTTGCCCAGC-3' |