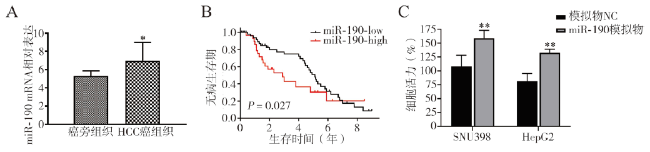
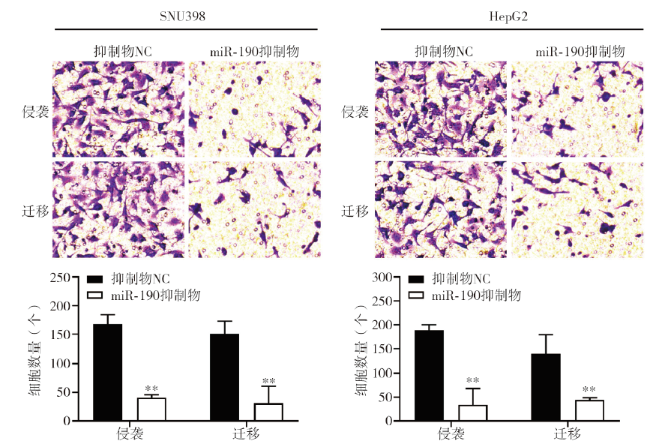
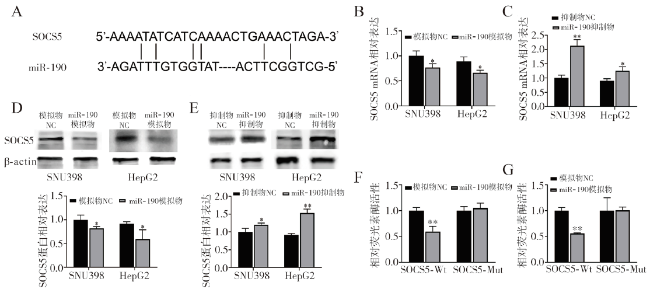
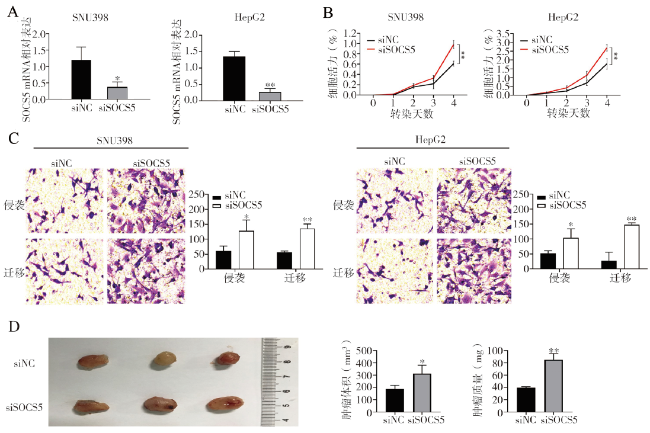
当miR-190过表达时,SOCS5在HCC细胞系中下调,由此我们推测SOCS5是miR-190的潜在靶点。SOCS5在人类癌症中的作用已被研究,在前列腺癌和肝癌中已经检测到SOCS5的下调
[6]。据报道,抑制miR-18a-5p促进SOCS5而诱导骨肉瘤细胞凋亡
[7]。随后,我们使用荧光素酶检测法证明了它确实是miR-190的靶点,同时,miR-190还能调节其转录和蛋白水平。有趣的是,SOCS基因是JAK/STAT通路中负反馈回路的一部分
[8]。众所周知,JAK/STAT途径可激活细胞的增殖、迁移、分化、凋亡以及抑制剂的失调,导致包括肝癌在内的人类疾病
[9]。Yuan等
[10]研究发现,miR-30a靶向SOCS-1,并通过JAK/STAT信号通路抑制脓毒症大鼠的肝细胞增殖和促进细胞凋亡。Wang等
[11]发现了板蓝根多糖通过激活JAK/STAT信号通路来发挥对HBV的体外抗病毒作用。考虑到目前SOCS5与肝癌的相关研究较少,我们进行了额外实验来验证SOCS5在肝癌中的作用,结果证明了SOCS5在体内和体外都可作为HCC的肿瘤抑制因子。以上结果表明,在HCC中,由miR-190介导的SOCS5下调将导致JAK/STAT通路的激活,进而促进细胞增殖、侵袭和迁移。有研究报道miR-885-5p上调通过靶向抑制SOCS5促进大肠癌细胞增殖和迁移,我们的研究结果与其一致
[12]。