对象与方法
一、研究对象
二、临床资料收集
三、诊断标准及检测/评分项目
四、血培养
五、统计学处理
结果
一、一般情况
二、病原菌构成及其耐药性
表1 急性白血病合并脓毒性休克患儿病原菌构成情况 |
| 病原菌 | 菌株数 | 构成比/% | 病原菌 | 菌株数 | 构成比/% |
|---|---|---|---|---|---|
| G-菌 | 33 | 70.21 | G+菌 | 12 | 25.53 |
| 铜绿假单胞菌 | 8 | 17.02 | 表皮葡萄球菌 | 2 | 4.26 |
| 大肠埃希菌 | 6 | 12.77 | 缓症链球菌 | 2 | 4.26 |
| 嗜麦芽寡养单胞菌 | 5 | 10.64 | 金黄色葡萄球菌 | 2 | 4.26 |
| 肺炎克雷伯菌 | 4 | 8.51 | 溶血葡萄球菌 | 2 | 4.26 |
| 枯草芽孢杆菌 | 3 | 6.38 | 屎肠球菌 | 1 | 2.13 |
| 鲍曼不动杆菌 | 1 | 2.13 | 人葡萄球菌人亚种 | 1 | 2.13 |
| 脑膜脓毒性黄杆菌 | 1 | 2.13 | 沃氏葡萄球菌 | 1 | 2.13 |
| 产黑素普雷沃菌 | 1 | 2.13 | 肺炎链球菌 | 1 | 2.13 |
| 黏质沙雷菌 | 1 | 2.13 | 真菌 | 2 | 4.26 |
| 嗜水气单胞菌 | 1 | 2.13 | 热带念珠菌 | 1 | 2.13 |
| 克氏柠檬酸杆菌 | 1 | 2.13 | 未分类 | 1 | 2.13 |
| 人苍白杆菌 | 1 | 2.13 |
表2 急性白血病合并脓毒性休克患儿主要G-菌对抗菌药物的耐药性 |
| 抗菌药物 | 铜绿假单胞菌(8株) | 大肠埃希菌(6株) | 嗜麦芽寡养单胞菌(5株) | 肺炎克雷伯菌(4株) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S | R | ND | S | R | ND | S | R | ND | S | R | ND | ||||
| TZP | 6 | 1 | 1 | 5 | 1 | 0 | 0 | 0 | 5 | 4 | 0 | 0 | |||
| TIM | 1 | 2 | 5 | 0 | 0 | 6 | 2 | 3 | 0 | 0 | 0 | 4 | |||
| SCF | 4 | 2 | 2 | 3 | 1 | 2 | 0 | 0 | 5 | 4 | 0 | 0 | |||
| CAZ | 5 | 1 | 2 | 5 | 1 | 0 | 2 | 3 | 0 | 3 | 1 | 0 | |||
| FEP | 6 | 1 | 1 | 4 | 2 | 0 | 0 | 0 | 5 | 4 | 0 | 0 | |||
| IPM | 6 | 2 | 0 | 5 | 1 | 0 | 0 | 5 | 0 | 4 | 0 | 0 | |||
| MEM | 5 | 2 | 1 | 5 | 1 | 0 | 0 | 5 | 0 | 2 | 0 | 2 | |||
| LEV | 7 | 1 | 0 | 0 | 6 | 0 | 5 | 0 | 0 | 4 | 0 | 0 | |||
| TGC | 0 | 0 | 8 | 5 | 0 | 1 | 0 | 0 | 5 | 1 | 0 | 3 | |||
| SXT | 0 | 1 | 7 | 1 | 4 | 1 | 5 | 0 | 0 | 2 | 2 | 0 | |||
注:TZP为哌拉西林/他唑巴坦;TIM为替卡西林/克拉维酸;SCF为头孢哌酮/舒巴坦:CAZ为头孢他啶;FEP为头孢吡肟;IPM为亚胺培南;MEM为美罗培南;LEV为左氧氟沙星;TGC为替加环素;SXT为复方新诺明;S为敏感;R为耐药;ND为未针对该抗菌药物进行药物敏感性试验。 |
表3 急性白血病合并脓毒性休克患儿主要G+菌对抗菌药物的耐药性 |
| 抗菌药物 | 表皮葡萄球菌(2株) | 金黄色葡萄球菌(2株) | 溶血葡萄球菌(2株) | 缓症链球菌(2株) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S | R | S | R | S | R | S | R | ND | ||||
| P | 1 | 1 | 0 | 2 | 0 | 2 | 1 | 0 | 1 | |||
| OX | 1 | 1 | 1 | 1 | 0 | 2 | 0 | 0 | 2 | |||
| DA | 1 | 1 | 0 | 2 | 2 | 0 | 2 | 0 | 0 | |||
| TEC | 2 | 0 | 2 | 0 | 1 | 1 | 0 | 0 | 2 | |||
| VA | 2 | 0 | 2 | 0 | 2 | 0 | 2 | 0 | 0 | |||
| LZD | 2 | 0 | 2 | 0 | 2 | 0 | 2 | 0 | 0 | |||
| LEV | 0 | 2 | 2 | 0 | 0 | 2 | 1 | 1 | 0 | |||
| TGC | 2 | 0 | 2 | 0 | 2 | 0 | 0 | 0 | 2 | |||
注:P为青霉素;OX为苯唑西林;DA为克林霉素;TEC为替考拉宁;VA为万古霉素;LZD为利奈唑烷;LEV为左氧氟沙星;TGC为替加环素;S为敏感;R为耐药;ND为未针对该抗菌药物进行药物敏感性试验。 |
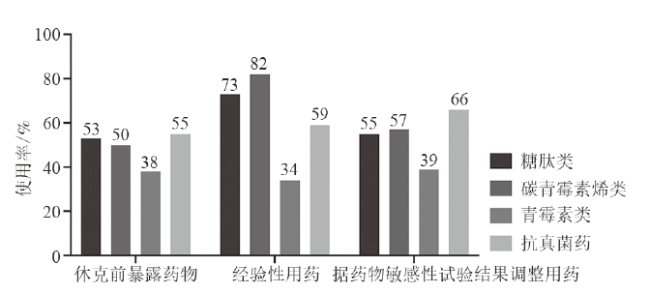
三、感染部位及药物使用情况
四、G-菌与G+菌感染患儿临床特征比较
表4 G-菌与G+菌感染患儿临床特征比较 |
| 项 目 | G-菌组(29例) | G+菌组(10例) | 统计量 | P值 |
|---|---|---|---|---|
| 男性/例(%) | 17(58.6) | 4(40.0) | — | 0.465 |
| 年龄/岁 | 6.6±3.9 | 8.5±4.1 | -1.342 | 0.188a |
| 基础疾病/例(%) ALL AML | 23(79.3) 6(20.7) | 9(90.0) 1(10.0) | — | 0.653a |
| 脓毒性休克前状态 原发病缓解/例(%) 住院时间/d 粒细胞缺乏时间/d 发热持续时间/d 抗菌药物暴露时间/d | 11(37.9) 24.5±12.8 10.0(6.0,18.5) 1.0(0.4,5.0) 6.0(1.0,21.5) | 5(50.0) 21.2±15.8 14.5(5.8,23.5) 2.0(0.5,4.5) 1.0(0,9.5) | — 0.650 -0.821 -1.988 | 0.711a 0.520 0.412a 0.747a 0.047 |
| 脓毒性休克前可识别感染灶/例(%) 肺部 消化道 皮肤黏膜 泌尿系统 | 18(62.1) 10(34.5) 4(13.8) 1(3.4) | 5(50.0) 3(30.0) 0(0) 0(0) | — — — — | 0.711a 1.000a 0.556a 1.000a |
| 脓毒性休克发生时的生命体征 体温/℃ | 39.4±0.9 | 39.0±0.9 | 1.137 | 0.263 |
| 呼吸/(次/分) | 35.4±12.5 | 34.4±12.3 | 0.222 | 0.825 |
| 心率/(次/分) | 153.0±29.6 | 138.7±27.4 | 1.341 | 0.188 |
| 平均动脉压/mmHg | 47.3±8.0 | 49.8±7.5 | -0.858 | 0.397 |
| CRP/(mg/L) | 144.3(85.2,200) | 77.0(14.2,188.6) | -1.921 | 0.055 |
| 降钙素原/(ng/mL) | 19.3(2.8,58.9) | 4.2(1.0,20.9) | -1.737 | 0.082 |
| 初始乳酸/(mmol/L) | 3.3(1.6,7.8) | 2.5(0.8,5.0) | -0.889 | 0.374 |
| MDRO/例(%) | 14(48.3) | 5(50.0) | — | 1.000 |
| 24 h pSOFA /分 | 8.0(7.0,12.0) | 8.0(6.5,11.3) | -0.617 | 0.538 |
| 24 h PCIS/分 | 78.0±8.2 | 81.4±8.7 | -1.116 | 0.272 |
| 24 h VIS /分 | 35.0(10.0,84.0) | 50.0(10.0,82.5) | -0.129 | 0.897 |
| 血管活性药物疗程/d | 2.0(0.8,5.5) | 3.0(1.8,4.5) | -0.438 | 0.661 |
| 变力扩血管药/例(%) | 4(13.8) | 1(10.0) | — | 1.000a |
| 有创机械通气/例(%) | 13(44.8) | 2(20.0) | — | 0.263a |
| 血液净化/例(%) | 4(13.8) | 0(0) | — | 0.556a |
| PICU住院时长/d | 2.0(0.4,8.0) | 1.4(0,12.0) | -0.696 | 0.486 |
| 28 d内死亡/例(%) | 10(34.5) | 3(30.0) | — | 1.000a |
注:pSOFA为儿童序贯器官衰竭评分;PCIS为小儿危重病例评分;VIS为血管活性药物评分;1 mmHg = 0.133 kPa;a采用Fisher确切概率法。 |
五、MDRO感染高危因素
表5 MDRO感染与非MDRO感染患儿主要临床特征比较 |
| 项 目 | MDRO组(19例) | 非MDRO组(17例) | 统计量 | P值 |
|---|---|---|---|---|
| 基础疾病为ALL/例(%) 原发病缓解/例(%) | 15(78.9) 5(26.3) | 14(82.4) 8(47.1) | — — | 1.000a 0.299a |
| 脓毒性休克前 住院时间/d 粒细胞缺乏时间/d 发热持续时间/d 抗菌药物暴露时间/d | 27.8±13.7 13.0(5.0,24.0) 3.0(0.5,4.5) 5.0(0.8,25.5) | 18.1±12.7 10.0(6.0,19.0) 1.5(0.5,5.8) 1.0(0.3,10.8) | -2.203 -0.396 -0.254 -2.099 | 0.035 0.692 0.799 0.036 |
| 24 h pSOFA/分 | 11.0(8.0,13.0) | 8.0(7.3,12.0) | -0.448 | 0.654 |
| 24 h PCIS/分 | 78.0(68.0,80.0) | 77.0(74.5,80.0) | -0.814 | 0.416 |
| 24 h VIS/分 | 80.0(35.0,121.3) | 52.5(15.0,84.5) | -0.492 | 0.626 |
| 血管活性药物疗程/d | 2.0(0.2,6.0) | 3.5(2.0,6.8) | -1.675 | 0.094 |
| 变力扩血管药/例(%) | 2(10.5) | 2(11.8) | — | 1.000a |
| 有创机械通气/例(%) | 8(42.1) | 6(35.3) | — | 0.742a |
| 血液净化/例(%) | 2(10.5) | 2(11.8) | — | 1.000a |
| PICU住院时长/d | 2.0(0.4,12.5) | 5.0(0.9,11.3) | -0.783 | 0.434 |
| 28 d内死亡/例(%) | 7(36.8) | 6(35.3) | — | 1.000a |
注:pSOFA为儿童序贯器官衰竭评分;PCIS为小儿危重病例评分;VIS为血管活性药物评分;a采用Fisher确切概率法。 |