对象与方法
一、研究对象
二、方法
1. 研究方案设计
2. 血清代谢指标的检测
3. BDM的测定
4. 妊娠期相关并发症评估方法
三、观察内容
四、统计学处理
结果
一、研究对象的一般情况
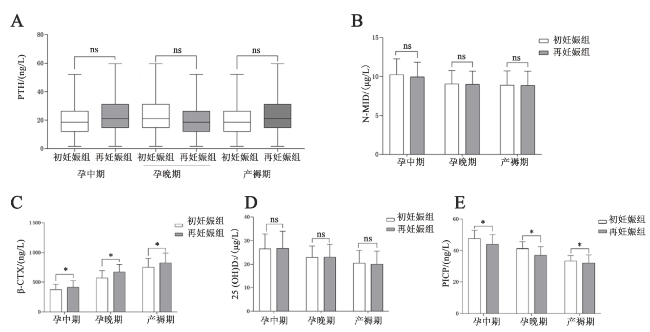
二、不同妊娠情况妇女在孕中晚期及产褥期的血清代谢指标情况比较
三、不同年龄段再妊娠妇女血清代谢指标情况比较
表1 不同年龄段再妊娠妇女妊娠中晚期及产褥期血清代谢指标情况比较 |
| 检测时点 | 年龄段 | 例数 | PTH/(ng/L) | N-MID/(μg/L) | β-CTX/(ng/L) | 25 (OH)D3/(μg/L) | PICP/(ng/L) |
|---|---|---|---|---|---|---|---|
| 孕中期 | 25~30岁 | 17 | 22.5(13.3,34.1) | 10.07±1.57 | 415±88 | 29.2±9.4 | 44.1±5.0 |
| 31~35岁 | 55 | 23.3(15.5,31.4) | 9.90±2.10 | 411±121 | 27.0±5.1 | 43.9±6.9 | |
| 36~40岁 | 28 | 18.7(13.7,25.1) | 10.05±1.58 | 421±92 | 21.0±4.7c | 44.8±5.3 | |
| H/F | 0.169 | 0.084 | 0.038 | 4.481 | 0.088 | ||
| P | 0.429 | 0.920 | 0.962 | 0.010 | 0.916 | ||
| 孕晚期 | 25~30岁 | 17 | 28.9(20.9,35.0) | 9.12±1.27 | 663±108 | 26.2±4.2 | 35.5±5.5 |
| 31~35岁 | 55 | 20.5(16.2,28.9) | 8.98±1.67 | 682±135 | 23.5±4.3c | 37.6±5.5 | |
| 36~40岁 | 28 | 24.3(14.3,32.4) | 9.01±2.01 | 669±122 | 20.0±4.3cd | 37.3±5.1 | |
| H/F | 4.287 | 0.200 | 0.449 | 13.056 | 0.444 | ||
| P | 0.117 | 0.819 | 0.640 | <0.001 | 0.643 | ||
| 产褥期 | 25~30岁 | 17 | 41.0(30.0,48.5) | 8.32±1.62 | 796±137 | 24.4±5.7 | 33.2±4.6 |
| 31~35岁 | 55 | 32.7(19.3,48.8) | 8.95±1.88 | 838±163 | 20.7±4.8c | 32.3±5.4 | |
| 36~40岁 | 28 | 30.4(12.6,42.4) | 8.99±1.87 | 833±179 | 17.6±4.4cd | 31.3±5.2 | |
| H/F | 3.432 | 0.761 | 0.089 | 11.854 | 0.699 | ||
| P | 0.180 | 0.470 | 0.915 | <0.001 | 0.499 |
注:与产褥期25~30岁年龄段比较,cP< 0.05;与产褥期31~35岁年龄段比较,dP < 0.05。 |
四、不同骨代谢状况下再妊娠妇女妊娠期并发症情况
表2 不同骨代谢状况下再妊娠妇女妊娠期并发症情况 [例(%)] |
| 骨量状况 | 例数 | 亚临床甲减 | GDM |
|---|---|---|---|
| 异常 | 24 | 9(37.5) | 9(37.5) |
| 正常 | 76 | 5(6.6) | 10(13.2) |
| χ 2值 | 12.030a | 5.530a | |
| P值 | 0.001a | 0.019a |
注:a连续校正性χ 2检验。 |