1 对象与方法
1.1 研究对象
1.2 研究方法
1.3 统计学方法
2 结果
2.1 一般资料
表1 观察组和对照组患儿临床资料比较Table 1 Comparison of clinical data between the observation group and the control group |
| 变 量 | 观察组(n=60) | 对照组(n=25) | χ 2/t/Z值 | P值 | 差值95%可信区间 | |
|---|---|---|---|---|---|---|
| 下限 | 上限 | |||||
| 男性/n(%) | 29(48.3) | 17(68.0) | 2.749 | 0.097 | -0.42 | 0.03 |
| 年龄/岁 | 1.64±0.55 | 1.74±0.53 | 0.717 | 0.476 | -0.35 | 0.16 |
| WBC/(×109/L) | 7.15(5.73,9.98) | 6.80(5.80,8.48) | 0.531 | 0.335 | -0.90 | 1.80 |
| ANC/(×109/L) | 3.10(2.48,6.25) | 2.57(1.86,4.70) | 1.621 | 0.700 | -0.20 | 1.49 |
| ALC/(×109/L) | 2.80(2.10,3.61) | 3.10(2.33,4.15) | 0.888 | 0.300 | -0.90 | 0.36 |
| Hb/(g/L) | 120.1±10.3 | 117.8±9.6 | 0.962 | 0.339 | -0.25 | 0.71 |
| PLT/(×109/L) | 297.67±88.39 | 304.36±88.64 | 0.318 | 0.751 | -48.58 | 35.19 |
| CRP/(mg/L) | 2.60(0.90,7.50) | 4.00(1.56,6.45) | 0.874 | 0.382 | -2.80 | 0.80 |
| 轮状病毒阳性/n(%) | 17(28.3) | 2(8.0) | 4.204 | 0.040 | 0.05 | 0.36 |
| 诺如病毒阳性/n(%) | 40(66.7) | 9(36.0) | 6.797 | 0.009 | 0.08 | 0.53 |
| IL-2/(pg/mL) | 0.44(0.30,0.83) | 0.30(0.30,0.69) | 1.019 | 0.308 | -0.04 | 0.23 |
| IL-4/(pg/mL) | 0.31(0.20,1.03) | 0.30(0.20,0.75) | 0.395 | 0.693 | -0.10 | 0.12 |
| IL-6/(pg/mL) | 3.20(1.42,6.49) | 0.60(0.30,2.33) | 4.341 | <0.001 | 0.96 | 3.31 |
| IL-10/(pg/mL) | 6.13(4.29,9.15) | 3.10(0.30,6.91) | 3.535 | <0.001 | 1.84 | 4.70 |
| TNF-α/(pg/mL) | 0.58(0.30,0.87) | 0.20(0.20,0.60) | 3.185 | 0.001 | 0.10 | 0.38 |
| IL-17A/(pg/mL) | 0.90(0.53,1.10) | 0.90(0.30,0.90) | 1.111 | 0.267 | -0.03 | 0.50 |
2.2 BICE影响因素分析
2.3 惊厥发作次数与肠道病毒、细胞因子水平的相关性分析
表2 惊厥发作次数与肠道病毒、细胞因子的相关性分析Table 2 Correlation analysis between the number of convulsions and enterovirus and cytokine |
| 变 量 | 惊厥发作次数 | |
|---|---|---|
| rs值 | P值 | |
| 轮状病毒 | 0.159 | 0.147 |
| 诺如病毒 | 0.255 | 0.018 |
| IL-2 | 0.087 | 0.428 |
| IL-4 | -0.026 | 0.812 |
| IL-6 | 0.542 | <0.001 |
| IL-10 | 0.599 | <0.001 |
| TNF-α | 0.405 | <0.001 |
| IL-17A | 0.055 | 0.619 |
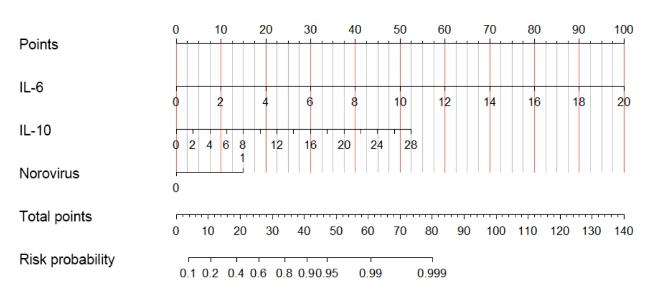
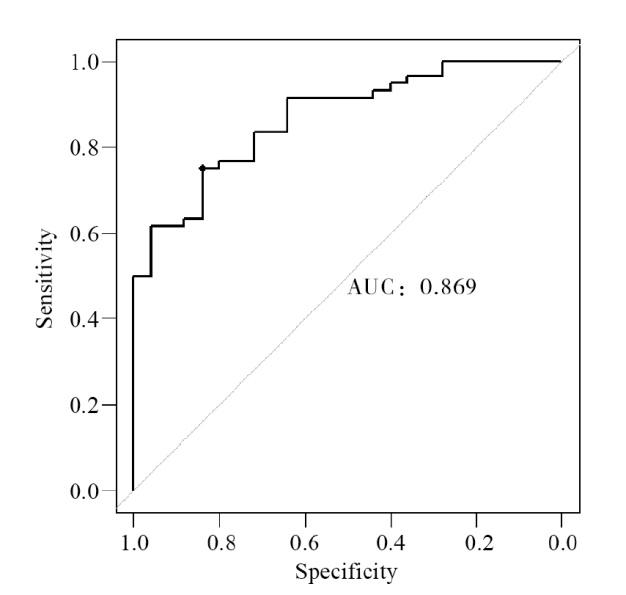
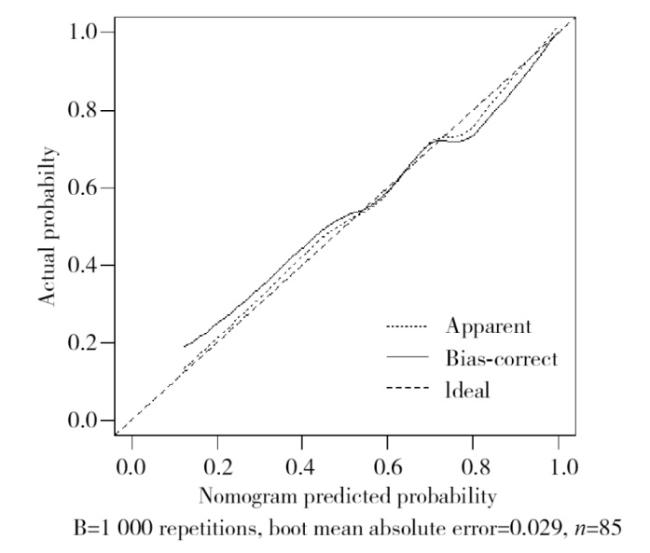
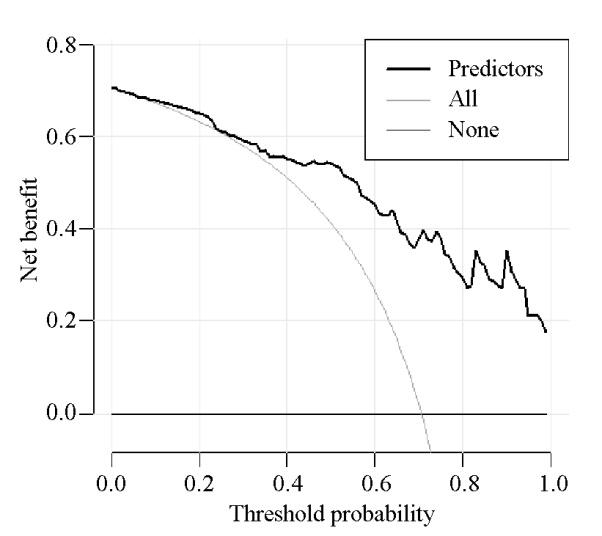
2.4 多因素Logistic回归分析
表3 BICE的多因素Logistic回归分析Table 3 Multivariate logistic regression analysis of BICE |
| 变量 | β值 | β值标准误 | Wald χ 2值 | P值 | OR值 | OR值的95%CI | |
|---|---|---|---|---|---|---|---|
| 下限 | 上限 | ||||||
| IL-6 | 0.609 | 0.216 | 7.994 | 0.005 | 1.839 | 1.206 | 2.806 |
| IL-10 | 0.235 | 0.098 | 5.735 | 0.017 | 1.264 | 1.044 | 1.532 |
| 诺如病毒阳性 | 1.734 | 0.665 | 6.797 | 0.009 | 5.662 | 1.538 | 20.849 |
注:赋值如下,分组数据(观察组赋值为2,对照组赋值为1),诺如病毒(阴性赋值为0,阳性赋值为1),IL-6(实际值),IL-10(实际值)。 |