1 材料与方法
1.1 材料
1.2 方法
1.2.1 细胞培养
1.2.2 染色标记间充质干细胞
1.2.3 构建间充质干细胞与内皮细胞3D仿生分布设计支架
1.2.4 细胞增殖实验
1.2.5 细胞划痕实验
1.2.6 支架血管化比较
1.2.7 定量实时聚合酶链反应
1.2.8 统计学方法
2 结果
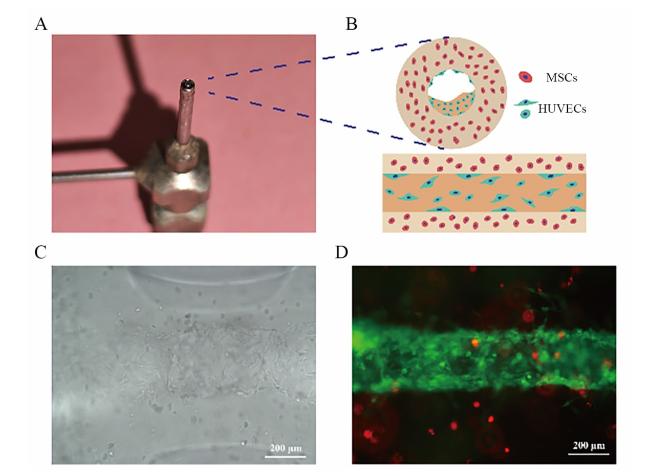
2.1 成功构建Shell-Core支架
图1 间充质干细胞与人脐静脉内皮细胞3D仿生分布设计组织工程支架的构建注: A为同轴喷嘴外观;B为含MSCs的壳通道生物墨水与含HUVECs的核通道生物墨水同时挤出形成仿生分区的条状纤维横切面与纵切面示意图;C为体外培养第2日光学显微镜下所见(×200,标尺为200 μm);D为培养第7日荧光显微镜下所见,Dil-MSCs显示红色,GFP-HUVECs显示绿色(×200,标尺为200 μm)。 Figure 1 Tissue engineering scaffold of a 3D bionic distribution design scaffold for mesenchymal stem cells and human umbilical vein endothelial cells |
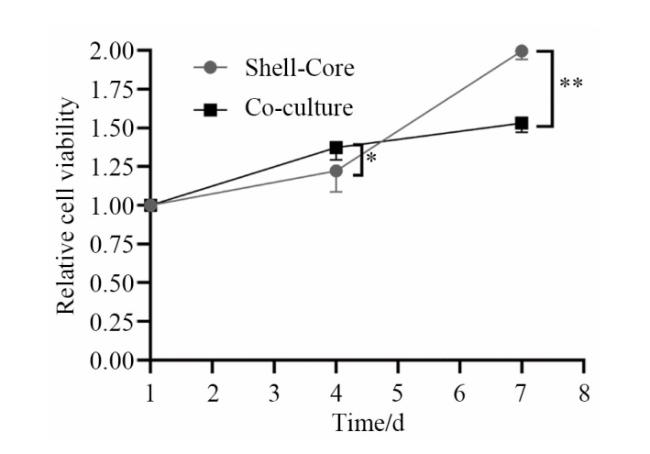
2.2 细胞增殖实验
2.3 细胞划痕实验
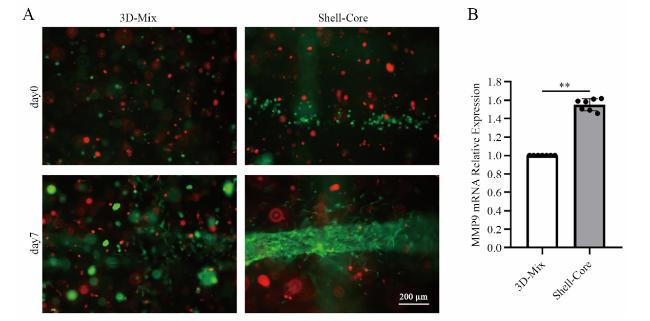
2.4 支架血管化与qRT -PCR结果
图4 间充质干细胞与人脐静脉内皮细胞3D仿生分布设计组织工程支架中人脐静脉内皮细胞的体外自组装注:A为体外培养第0和7日荧光显微镜下所见的细胞分布(×100,标尺为200 μm),Dil-MSCs显示红色,GFP-HUVECs显示绿色;B为MMP-9的mRNA相对表达量比较;**P < 0.01。 Figure 4 In vitro self-assembly of human umbilical vein endothelial cells in the 3D bionic distribution design tissue engineering scaffold of mesenchymal stem cells and human umbilical vein endothelial cells |