1 对象与方法
1.1 研究对象
1.2 分组
1.3 观察内容
1.4 统计学方法
2 结果
2.1 临床资料分布
2.2 各项指标与OSAHS发生的相关性
表1 非OSAHS组与OSAHS组各项指标比较及各项指标与OSAHS发生的相关性分析Table 1 Comparison of various indicators between the non-OSAHS group and the OSAHS group and the correlation analysis of various indicators with the occurrence of OSAHS |
| 指 标 | 非OSAHS组(n=54) | OSAHS组(n=189) | χ 2/t/Z值 | P值 |
|---|---|---|---|---|
| 性别/n(%) | 7.549 | 0.006 | ||
| 男 | 10(18.5) | 73(38.6) | ||
| 女 | 44(81.5) | 116(61.4) | ||
| 年龄/岁 | 29.70±9.44 | 33.49±8.20 | -2.686 | 0.007 |
| 身高/cm | 165.00(162.00,170.00) | 166.00(162.00,172.00) | -0.907 | 0.365 |
| 体重/kg | 98.50(93.00,116.25) | 120.00(101.00,139.60) | -4.141 | <0.001 |
| BMI/(kg/m²) | 37.00(34.98,42.08) | 42.50(37.75,47.85) | -4.353 | <0.001 |
| 颈围/cm | 40.50(38.00. 44.00) | 43.00(40.00,47.50) | -3.543 | <0.001 |
| 腹围/cm | 120.98±13.29 | 127.71±15.97 | -5.888 | <0.001 |
| 臀围/cm | 120.00(115.00,128.50) | 128.00(118.00,139.00) | -5.338 | <0.001 |
| 空腹血糖/(mmol/L) | 5.02(4.41,5.86) | 5.37(4.71,6.81) | -2.182 | 0.029 |
| 甘油三酯/(mmol/L) | 1.53(1.05,2.05) | 1.54(1.21,2.24) | -0.976 | 0.329 |
| 总胆固醇/(mmol/L) | 5.14(4.55,5.57) | 5.12(4.41,5.87) | -0.271 | 0.786 |
| 高密度脂蛋白胆固醇/(mmol/L) | 1.18(1.10,1.32) | 1.14(0.99,1.32) | -1.576 | 0.115 |
| 低密度脂蛋白胆固醇/(mmol/L) | 3.29(2.84,3.73) | 3.17(2.76,3.78) | -0.315 | 0.753 |
| 血清肌酐/(μmol/L) | 56.45(46.33,63.50) | 54.90(47.75,66.55) | -0.595 | 0.552 |
| 血尿酸/(μmol/L) | 409.52±100.08 | 413.64±92.10 | -0.582 | 0.985 |
| 丙氨酸氨基转移酶/(U/L) | 29.40(20.08,56.50) | 39.70(25.05,63.20) | -1.349 | 0.177 |
| 天冬氨酸氨基转移酶/(U/L) | 56.45(46.33,63.50) | 27.10(21.15,37.30) | -1.812 | 0.070 |
| AHI/(次/小时) | 2.70(1.78,4.12) | 21.60(11.75,47.90) | -11.202 | <0.001 |
| CVAI | 154.60(129.24,174.43) | 207.59(160.15,270.58) | -5.727 | <0.001 |
2.3 行BMS的MetS患者的OSAHS风险Logistic回归分析
表2 共线性诊断结果Table 2 Result of collinearity diagnosis |
| 指 标 | B | SE | 容差 | VIF |
|---|---|---|---|---|
| 性别 | 0.165 | 0.138 | 0.142 | 7.046 |
| 年龄/岁 | 0.013 | 0.004 | 0.473 | 2.112 |
| 身高/cm | 0.000 | 0.018 | 0.033 | 30.037 |
| 体重/kg | -0.002 | 0.013 | 0.006 | 165.180 |
| BMI/(kg/m2) | 0.011 | 0.035 | 0.008 | 123.500 |
| 腹围/cm | 0.007 | 0.005 | 0.103 | 9.706 |
| CVAI | -0.001 | 0.002 | 0.046 | 21.703 |
表3 MetS合并OSAHS患者的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of patients with MetS combined with OSAHS |
| 指 标 | B | SE | Wald | OR (95%CI) | P值 |
|---|---|---|---|---|---|
| 年龄/岁 | 0.091 | 0.023 | 15.938 | 1.096(1.048,1.146) | <0.001 |
| 臀围/cm | 0.092 | 0.019 | 24.006 | 1.096(1.057,1.137) | <0.001 |
| CVAI | 0.017 | 0.003 | 25.863 | 1.017(1.011,1.024) | <0.001 |
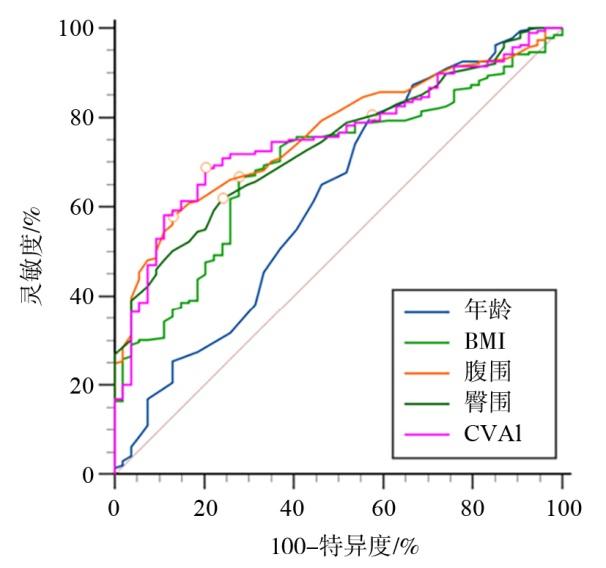
2.4 行BMS的MetS患者的OSAHS风险ROC曲线分析
表4 MetS患者合并OSAHS相关指标的ROC曲线分析Table 4 ROC curve analysis of indicators related to MetS patients combined with OSAHS |
| 指 标 | 约登指数 | 最佳截断值 | 灵敏度 | 特异度 | AUC (95%CI) | SE |
|---|---|---|---|---|---|---|
| 年龄 | 0.230 | 26.500 | 0.804 | 0.426 | 0.620(0.556,0.681) | 0.046 |
| BMI | 0.389 | 39.250 | 0.667 | 0.722 | 0.694(0.632,0.752) | 0.037 |
| 腹围 | 0.447 | 122.500 | 0.577 | 0.870 | 0.763(0.704,0.815) | 0.032 |
| 臀围 | 0.378 | 122.500 | 0.619 | 0.759 | 0.738(0.678,0.792) | 0.033 |
| CVAI | 0.484 | 182.310 | 0.688 | 0.796 | 0.756(0.697,0.808) | 0.033 |
图1 MetS患者合并OSAHS相关指标的ROC曲线Figure 1 The ROC curve of indicators related to MetS patients combined with OSAHS |
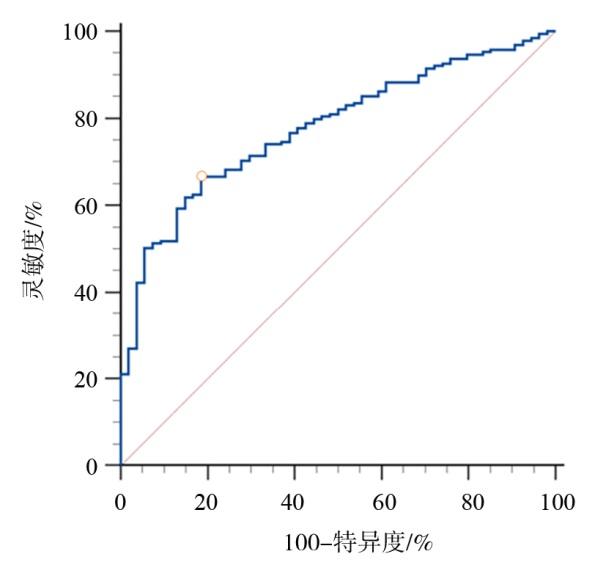
表5 指标组合前后ROC曲线下面积差异的DeLong检验结果Table 5 DeLong test results of differences in the area under the ROC curve before and after the combination of indicators |
| ROC曲线 | Z | AUC差异(95%CI) | SE | P |
|---|---|---|---|---|
| 年龄vs.臀围-CVAI | 2.738 | 0.159(0.045,0.272) | 0.058 | 0.006 |
| BMI vs.臀围-CVAI | 3.023 | 0.084(0.030,0.139) | 0.028 | 0.003 |
| 腹围vs.臀围-CVAI | 0.719 | 0.016(-0.027,0.058) | 0.022 | 0.472 |
| 臀围vs.臀围-CVAI | 2.108 | 0.040(0.003,0.078) | 0.019 | 0.035 |
| CVAI vs.臀围-CVAI | 1.603 | 0.023(-0.005,0.051) | 0.014 | 0.109 |
注:“年龄vs.臀围-CVAI”为年龄指标与组合变量指标在筛查是否合并OSAHS时的ROC曲线对比,余同理;AUC差异均代表组合后变量AUC值与原单一变量AUC值的差值。 |