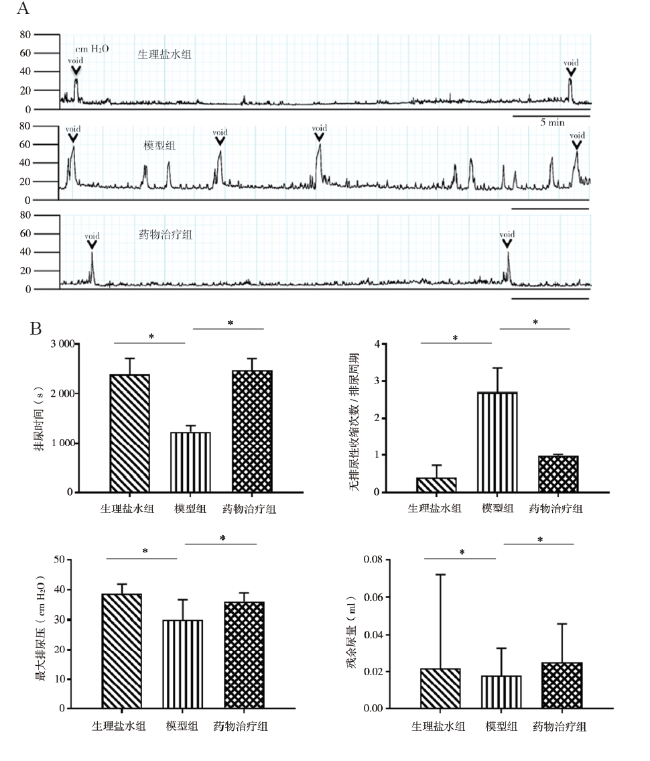
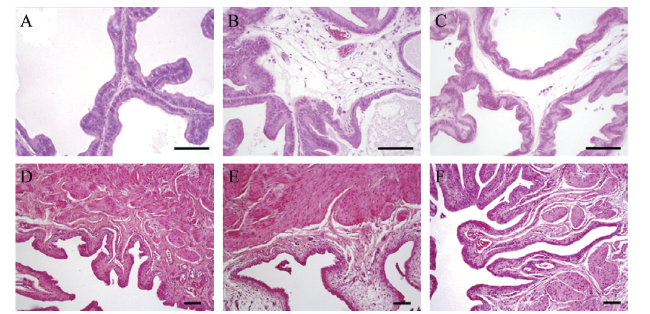
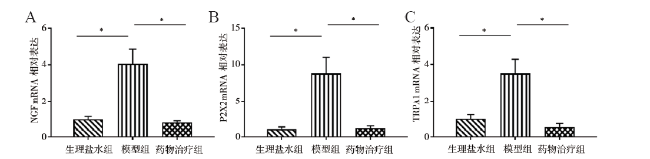
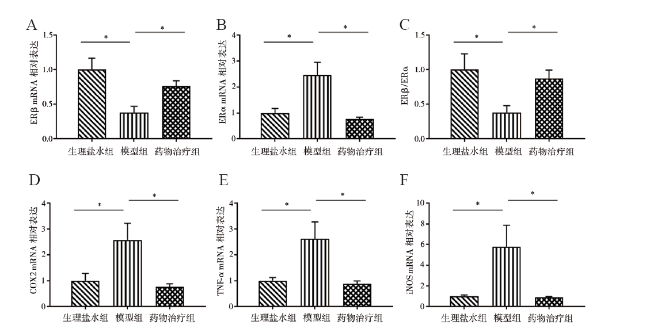
处死大鼠后打开腹腔,取前列腺腹侧叶和一部分膀胱黏膜组织至新的1.5 ml EP管中,用玻璃棒研磨,加入Trizol 1 ml充分振荡混匀,加入氯仿0.2 ml,盖紧后用力摇15 s,15 ~ 30 ℃孵育2 ~ 3 min,4 ℃ 12 000×g 离心15 min,取上清液,根据说明书使用Trizol试剂提取总RNA;使用ThermoScript RT-PCR系统将总RNA(1 mg)合成为模板DNA。引物分别为ERβ(NM_012754)、ERα(NM_012689)、TNF-α(NM_012675)、诱导型一氧化氮合酶(iNOS,XM_003750865)、环氧酶2(COX2,NM_017008)、三磷酸腺苷受体(P2X2,NM_207608)、瞬时受体电位通道A1(TRPA1,XM_008769306)、神经生长因子(NGF,NM_001277055)和内参基因GAPDH(NM_017008)。其中引物ERβ、ERα、TNF-α、COX2、NGF和GAPDH由QIAGEN(QuantiTect Primers)预先设计和验证,其他引物由Primer 3软件设计(
表1)。PCR反应体系50 μl,反应条件为:94 ℃ 30 s、55 ℃30 s、72 ℃ 60 s,最后72℃延伸7 min,共30个循环。SYBR Green法荧光定量PCR分析各基因的表达并利用2
-ΔΔCT法分析相应的数据,取每个靶基因与GAPDH的表达比值为相对表达的结果。