病例资料
一、主诉及病史
二、体格检查
三、实验室及辅助检查
表1 一例CV A6感染致NEC的新生儿入院后血常规、CRP、降钙素原检查结果 |
| 住院时间 | 白细胞 (×109/L) | 中性粒细胞(%) | 淋巴细胞(%) | 红细胞 (×1012/L) | 血红蛋白 (g/L) | 血小板 (109/L) | CRP (mg/L) | 降钙素原 (ng/ml) |
|---|---|---|---|---|---|---|---|---|
| 第1日 | 16.51 | 58.50 | 24.20 | 3.04 | 117 | 300 | 2.15 | 0.15 |
| 第2日 | 14.13 | 57.24 | 25.64 | 2.80 | 99 | 260 | 3.51 | 0.32 |
| 第4日 | 12.22 | 39.14 | 38.64 | 3.10 | 106 | 221 | 5.60 | 0.43 |
| 第10日 | 26.60 | 53.14 | 28.64 | 3.48 | 108 | 428 | 10.20 | 0.05 |
| 第22日 | 8.87 | 33.45 | 43.02 | 2.81 | 86 | 327 | 7.04 | 0.05 |
表2 一例CV A6感染致NEC的新生儿入院后粪便常规及潜血试验结果 |
| 住院时间 | 血液 | 黏液 | 红细胞(/HP) | 白细胞(/HP) | 潜血 |
|---|---|---|---|---|---|
| 第1日 | - | - | 未见 | 未见 | - |
| 第4日 | + | - | 0 ~ 3 | + | ++++ |
| 第10日 | - | - | 未见 | 未见 | - |
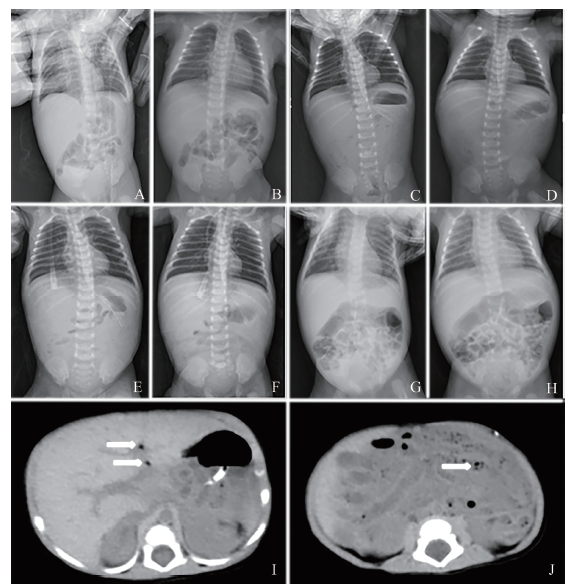
图1 一例CV A6感染致NEC的新生儿影像学检查图A、B:入院时急查腹部立位及卧位片,双膈下未见明显游离气体,腹部肠管见少许积气,肠管未见明显扩张及气液平,肠壁未见明显积气影,门静脉区未见明显积气;C、D住院第4日腹部立位及卧位片,腹部密实,大部分大小肠管未见明显充气,腹部见散在多发细线状、环状透亮影,肝门区周围亦似见线状透亮影(门静脉积气?),考虑新生儿NEC可能性大,立位左膈下内侧见可疑的少许透亮气体影,右膈下未见游离气体影;E、F:住院第5日腹部立位及卧位片,立位膈下未见明显游离气体影,门静脉积气及肠壁积气较前减少,小肠腔内积气较前增多;G、H:住院第26日腹部立位及卧位片,立位膈下未见明显游离气体影,门静脉及肠壁未见明显积气,小肠腔内积气较前增多;I、J:住院第5日腹部CT,肠管普遍性积液,肠壁稍厚,门静脉左支及其分支多发积气,拟NEC可能,I的箭头指示为门静脉积气,J的箭头指示为肠壁增厚 |
四、诊治及随访
神情疲倦,肤色较苍白,全身可见花斑纹,心率增快,呼吸不促,无发绀,腹软,肠鸣音存在,肢端凉,急查腹部立位及卧位片提示“NEC、肠穿孔?”,见图1C、D,考虑诊断为NEC、肠穿孔、感染性休克,予禁食、胃肠减压、生理盐水扩容、升级抗生素[美罗培南 20 mg/kg、每8 h 1次,青霉素30 U/(kg·d)],请小儿外科专家会诊,拟继续予保守治疗。加予补液、止血、输注血浆等处理后,患儿生命体征恢复稳定,精神反应好转,肤色转红润,全身花斑纹基本消退。住院第5日复查腹部立位及卧位片示立位膈下未见明显游离气体影,门脉积气及肠壁积气较前减少,小肠腔内积气较前增多,见图1E、F;腹部CT提示肠管普遍性积液,肠壁稍厚,门脉左支及其分支多发积气,拟NEC可能,见图1I、J。住院第6日患儿脑脊液检查未见异常,监测其生命体征平稳,精神反应好转,无发绀,腹软,肠鸣音正常,肢端暖和,胃肠引流出草绿色液体较前减少,临床症状逐渐好转。经禁食及抗生素治疗14 d后停用抗生素,重新开始喂养不含乳糖奶,患儿无腹胀、呕吐,住院第26日复查腹部立位及卧位片无异常,见图1G、H,住院第28日出院,按需喂养不含乳糖奶。出院诊断:NEC并肠穿孔、感染性休克;新生儿黄疸、新生儿贫血。患儿出院后我科收到粪便逆转录PCR(RT-PCR)结果:住院第2日、第23日粪便 CV A6阳性,补充诊断:新生儿CV感染。患儿出院后1个月、3个月、6个月及1年的门诊定期复诊结果均显示其体质量、身长达标,生长发育情况良好。