对象与方法
一、研究对象
二、临床资料收集
三、RF、抗CCP抗体和抗MCV抗体的检测及分组
四、统计学处理
结果
一、RA患者的一般特征
表1 148例RA患者的一般特征 |
| 项 目 | 结 果 |
|---|---|
| 年龄($\bar{x}±s$,岁) | 46.3±12.5 |
| 女性[例(%)] | 116(78.4) |
| 病程[中位数(下四分位数, 上四分位数),月] | 48(12,96) |
| 疼痛VAS(cm) | 4(2,6) |
| 28TJC[中位数(下四分位数, 上四分位数)] | 3(1,7) |
| 28SJC[中位数(下四分位数, 上四分位数)] | 2(0,6) |
| PtGA[中位数(下四分位数, 上四分位数),cm] | 4(2,6) |
| PrGA[中位数(下四分位数, 上四分位数),cm] | 4(2,6) |
| ESR[中位数(下四分位数, 上四分位数),mm/h] | 38(18,65) |
| CRP[中位数(下四分位数, 上四分位数),mg/L] | 8.75(3.30,30.10) |
| RF阳性[例(%)] | 107(72.3) |
| 抗CCP阳性[例(%)] | 110(74.3) |
| DAS28-CRP | 3.8(3.0,4.8) |
| 缓解[例(%)] | 26(17.6) |
| 轻度活动[例(%)] | 20(13.5) |
| 中度活动[例(%)] | 72(48.6) |
| 高度活动[例(%)] | 30(20.3) |
| SDAI[中位数(下四分位数, 上四分位数)] | 16.6(9.1,26.1) |
| CDAI[中位数(下四分位数, 上四分位数)] | 15.0(8.0,21.0) |
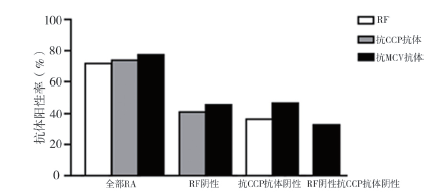
二、RA患者自身抗体阳性的分布及阳性率的比较
表2 148例RA患者自身抗体阳性的分布 |
| RF | 抗CCP抗体 | 抗MCV抗体 | 例数(%) |
|---|---|---|---|
| + | + | + | 86(58.1) |
| + | + | - | 7(4.7) |
| + | - | + | 10(6.8) |
| + | - | - | 4(2.7) |
| - | + | + | 11(7.4) |
| - | + | - | 6(4.1) |
| - | - | + | 8(5.4) |
| - | - | - | 16(10.8) |