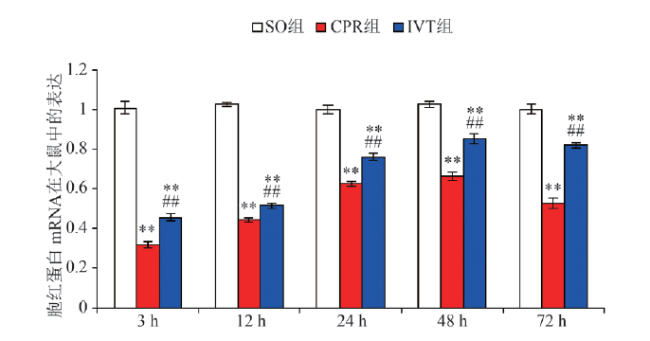
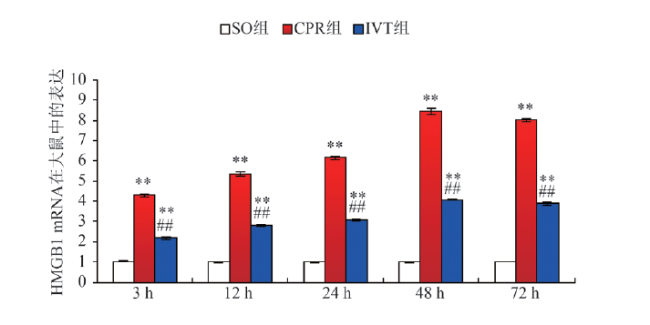
本实验通过ELISA法、免疫组化SABC法和qRT-PCR法定量结果表明,与SO组相比,CPR组大鼠血清和海马中对应的胞红蛋白浓度、D值和基因表达是降低的,但随时间延长而增加,24 h达高峰,48 h开始稍降低;而HMGB1浓度、D值和基因表达是增加的,并随时间延长而增加,48 h达高峰。血塞通干预治疗后,血清和海马中对应的胞红蛋白浓度、D值和基因表达与CPR组比较均明显增加,而HMGB1浓度、D值和基因表达则均明显降低。本实验中胞红蛋白和HMGB1在SO组和CPR组的表达趋势与前期研究是基本一致的。 虽然胞红蛋白和HMGB1在缺血再灌注过程中都有表达增强,但它们的意义不同。胞红蛋白的表达增强以保护组织免受缺氧为目的,而HMGB1则是负责启动细胞或组织的炎症反应。这可能因为缺血缺氧后,活化HIF-1,启动胞红蛋白出现应激表达,同时激活一氧化氮合成酶参与一氧化氮的清除,从而代偿性增加胞红蛋白输氧、运氧、储氧功能,以保证脑及周围组织的供氧,起到脑及周围组织的保护作用
[15]。通过血塞通干预治疗后大脑和外周血清中胞红蛋白的表达和含量都是增加的,这就可抑制NF-κB促炎因子的表达,炎症反应的枢纽受抑,因此级联反应就不会发生,从而可降低缺血/再灌注损伤,神经元凋亡也明显下降,可见其与神经及其他组织的修复与保护是一致的。但是心脏停搏/ CPR后48 h时,胞红蛋白的表达与含量反而减弱/降低了,其原因可能是氧的消耗与储备减少到一定程度时,与胞红蛋白结合减少,甚至没有结合,这时胞红蛋白在神经元中的表达就会减弱,血中的含量也就相应地减少。但具体机制还有待进一步研究。由此可见,通过本实验也证实胞红蛋白具有抗凋亡、携氧、储氧的功能,而血塞通可通过提高胞红蛋白对缺血缺氧的应答,在一定时间内参与周围细胞及神经元的保护作用。HMGB1可能具有多效性,其作用可能是缺血缺氧,刺激相关细胞迁移、固定及释放一些炎症介质,从而激活NF-κB介导的炎症枢纽,HMGB1在接受炎症信号后由细胞内移到细胞外,并与多种受体(主要为RAGE和TLRs)结合,启动多条信号传导途径,发生炎症级联反应,这就解释了本实验结果
[16]。有研究表明,HMGB1在心脏停搏患者复苏后,其脑脊液和血液中含量增高明显,与本实验结果也是一致的
[17]。而通过血塞通治疗后,HMGB1在大脑中的表达明显减弱,血清中含量也明显降低,从而达到对周围细胞及神经元的保护作用。