对象与方法
一、研究对象
二、研究方法
1. 分组
2. 研究指标和临床资料的收集
3. 麻醉与输血方法
三、统计学处理
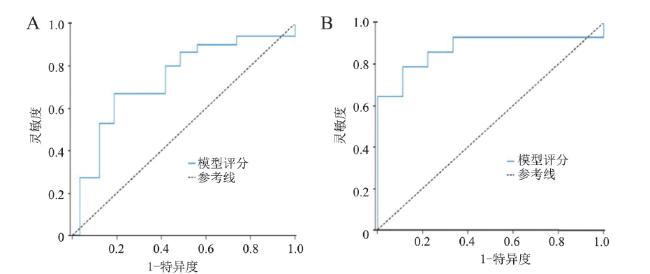
结果
一、建模人群分析
表1 建模人群婴幼儿颅内肿瘤切除术中大出血的单因素分析 |
| 指 标 | 大出血组(95例) | 中小出血组(183例) | χ2/U/t值 | P值 |
|---|---|---|---|---|
| 男性/例(%) | 60(63.2) | 104(56.8) | 1.035 | 0.309 |
| 年龄/月 | 23.0(10.0,40.0) | 34.0(20.0,58.0) | 5258.000 | <0.001 |
| 体质量/ kg | 11.5(8.0,14.5) | 13.5(11.0,19.0) | 4956.500 | <0.001 |
| 术中仰卧位/例(%) | 68(71.6) | 128(69.9) | 0.047 | 0.828 |
| 麻醉医师经验>5年/例(%) | 52(54.7) | 107(58.5) | 0.356 | 0.551 |
| 麻醉时间/min | 400.0(345.0,485.0) | 325.0(285.0,370.0) | 4368.500 | <0.001 |
| 手术时间/min | 356.5±101.4 | 257.9±70.9 | 8.457 | <0.001 |
| 肿瘤最大直径/cm | 5.9±1.9 | 4.0±1.9 | 7.81 | <0.001 |
| 活化部分凝血活酶时间/s | 39.7±5.4 | 39.8±5.2 | -0.206 | 0.837 |
| 凝血酶原时间活动度/% | 100.8±13.2 | 98.3±12.8 | 1.541 | 0.125 |
| 血红蛋白浓度/(g/L) | 117.0±16.4 | 120.6±15.7 | -1.789 | 0.075 |
| 红细胞计数/(×1012/L) | 4.6(4.3,4.9) | 4.6(4.1,5.0) | 8440.500 | 0.747 |
| 纤维蛋白原含量/(g/L) | 2.6(2.3,3.1) | 2.6(2.3,3.1) | 8547.500 | 0.878 |
| 凝血酶原时间/s | 13.2(12.7,13.8) | 13.5(12.8,13.9) | 7857.500 | 0.157 |
| 血小板计数/(×1012/L) | 354.0(301.5,447.5) | 345.5(296.0,417.8) | 6717.000 | 0.022 |
| 肿瘤恶性/例(%) | 89(93.7) | 149(81.4) | 7.635 | 0.006 |
| 术前颅脑手术史/例(%) | 20(21.1) | 23(12.6) | 3.443 | 0.064 |
| 肿瘤位于幕上/例(%) | 57(60.0) | 97(53.0) | 1.355 | 0.244 |
| 肿瘤单发/例(%) | 80(84.2) | 161(88.0) | 4.332 | 0.228 |
| 瘤周水肿/例(%) | 62(65.3) | 85(46.4) | 8.885 | 0.003 |
| 肿瘤边界清晰/例(%) | 52(54.7) | 137(74.9) | 11.639 | 0.001 |
| 累及重要血管/例(%) | 18(18.9) | 10(5.5) | 12.551 | 0.001 |
| 肿瘤有侵袭性/例(%) | 52(54.7) | 107(58.5) | 5.481 | 0.019 |
| 肿瘤组织学/例(%) | 0.244 | 0.807 | ||
| 胶质瘤 | 19(20.0) | 21(11.5) | ||
| 髓母细胞瘤 | 11(11.6) | 34(18.6) | ||
| 星形细胞肿瘤 | 10(10.5) | 25(13.7) | ||
| 原始神经外胚层肿瘤 | 13(13.7) | 21(11.5) | ||
| 颅咽管瘤 | 8(8.4) | 17(9.3) | ||
| 非典型畸胎样 | 7(7.4) | 13(7.1) |
二、建模人群中小出血组和大出血组的术后恢复情况比较
表2 建模人群不同出血组术后恢复情况的比较 |
| 指 标 | 大出血组(95例) | 中小出血组(183例) | χ2/t值 | P值 |
|---|---|---|---|---|
| 感染相关并发症/例(%) | 28(29.5) | 32(17.5) | 4.608 | 0.032 |
| 肺部感染 | 8(8.4) | 12(6.6) | 0.106 | 0.745 |
| 切口感染 | 3(3.2) | 4(2.2) | 0.008 | 0.931 |
| 颅内感染 | 19(20.0) | 15(8.2) | 7.029 | 0.008 |
| 非感染相关并发症/例(%) | 30(31.6) | 30(16.4) | 8.521 | 0.004 |
| 心律失常 | 2(2.1) | 3(1.6) | 0.039 | 0.843 |
| ARDS | 3(3.2) | 3(1.6) | 0.153 | 0.696 |
| 伤口延迟愈合 | 3(3.2) | 2(1.1) | 0.565 | 0.452 |
| 血肿清除术 | 2(2.1) | 3(1.6) | 0.039 | 0.843 |
| 脑脊液引流 | 3(3.2) | 4(2.2) | 0.008 | 0.931 |
| 昏迷 | 2(2.1) | 1(0.5) | 0.337 | 0.562 |
| 血流动力学不稳定 | 3(3.2) | 2(1.1) | 0.565 | 0.947 |
| 非计划性再次气管插管 | 2(2.1) | 2(1.1) | 0.071 | 0.452 |
| 尿崩症 | 2(2.1) | 3(1.6) | 0.039 | 0.843 |
| 低钠血症 | 2(2.1) | 3(1.6) | 0.039 | 0.843 |
| 凝血功能障碍 | 6(6.3) | 4(2.2) | 2.591 | 0.108 |
| 术后机械通气持续时间/d | 5±6 | 4±3 | 1.528 | 0.065 |
| 术后住院时间/d | 20±13 | 15±11 | 3.374 | 0.001 |
三、建模人群婴幼儿颅内肿瘤术中大出血的多因素logistic回归分析
表3 建模人群颅内肿瘤术中大出血风险评分模型的多因素logistic回归分析结果 |
| 项 目 | 回归系数 | 标准误 | Z值 | P值 | OR值 | 95% CI |
|---|---|---|---|---|---|---|
| 年龄 | -0.018 | 0.019 | -0.969 | 0.332 | 0.982 | 0.946 ~ 1.019 |
| 体质量 | -0.164 | 0.096 | -1.708 | 0.088 | 0.849 | 0.704 ~ 1.024 |
| 术前颅脑手术史 | 0.599 | 0.519 | 1.154 | 0.248 | 1.821 | 0.658 ~ 5.038 |
| 血红蛋白浓度 | -0.020 | 0.012 | -1.734 | 0.083 | 0.980 | 0.958 ~ 1.003 |
| 血小板计数 | 0 | 0.002 | 0.154 | 0.878 | 1.000 | 0.997 ~ 1.003 |
| 肿瘤最大直径 | 0.413 | 0.106 | 3.911 | < 0.001 | 1.512 | 1.229 ~ 1.860 |
| 肿瘤有侵袭性 | 0.142 | 0.486 | 0.291 | 0.771 | 1.152 | 0.444 ~ 2.988 |
| 累及重要血管 | 0.523 | 0.632 | 0.828 | 0.408 | 1.687 | 0.489 ~ 5.819 |
| 肿瘤边界清晰 | -0.536 | 0.415 | -1.292 | 0.196 | 0.585 | 0.260 ~ 1.319 |
| 瘤周水肿 | -0.053 | 0.399 | -0.134 | 0.894 | 0.948 | 0.434 ~ 2.071 |
| 麻醉时间 | 0.004 | 0.004 | 1.103 | 0.270 | 1.004 | 0.997 ~ 1.012 |
| 手术时间 | 0.011 | 0.004 | 2.907 | 0.004 | 1.011 | 1.004 ~ 1.019 |
| 恶性肿瘤 | -0.497 | 0.644 | -0.772 | 0.440 | 0.608 | 0.172 ~ 2.148 |
| 截距 | -3.811 | 2.328 | -1.637 | 0.102 | 0.022 | 0 ~ 2.121 |
注:OR为比值比,95% CI为95%置信区间。 |
表4 建模人群中二分类后婴幼儿颅内肿瘤术中大出血风险评分模型的logistic回归分析结果 |
| 指 标 | 回归系数 | 标准误 | Z值 | P值 | OR值 | 95% CI |
|---|---|---|---|---|---|---|
| 肿瘤最大直径 ≥ 4.5 cm | 1.706 | 0.295 | 5.775 | < 0.001 | 5.509 | 3.087 ~ 9.832 |
| 手术时间 ≥ 5 h | 0.946 | 0.333 | 2.842 | 0.004 | 2.276 | 1.341 ~ 4.947 |
| 截距 | -4.994 | 0.761 | -6.561 | < 0.001 | 0.007 | 0.002 ~ 0.030 |
注:OR为比值比; 95%CI为95%置信区间。 |