对象与方法
一、研究对象
二、主要试剂和抗体
三、细胞培养和处理
四、细胞活力测定
五、LDH、SOD和MDA试验
六、细胞凋亡检测
七、DHE染色
八、蛋白免疫印迹法
九、实时荧光定量(RT)-qPCR
十、统计学处理
结果
一、STEMI受试者血浆中的Elabela水平增加
表1 对照组和STEMI组基线资料比较 |
| 变 量 | 对照组(26例) | STEMI组(26例) | t / χ2值 | P值 |
|---|---|---|---|---|
| 男性/例(%) | 11(42) | 15(58) | 1.231 | 0.267 |
| 年龄 /岁 | 61.30±11.36 | 62.00±11.46 | 0.219 | 0.828 |
| 高血压/例(%) | 12(46) | 17(65) | 1.949 | 0.163 |
| 糖尿病/例(%) | 9(35) | 7(27) | 0.361 | 0.548 |
| 脑梗死/例(%) | 2(8) | 4(15) | 0.165 | 0.668 |
| 慢性肾脏病/例(%) | 0 | 0 | - | - |
| 外周血管疾病/例(%) | 0 | 0 | - | - |
| 吸烟史/例(%) | 9(35) | 14(54) | 1.949 | 0.163 |
| BMI/(kg/m2) | 26.10±2.87 | 25.60±1.91 | 0.742 | 0.461 |
| 高脂血症/例(%) | 5(19) | 6(23) | 0.115 | 0.734 |
| 收缩压/mmHg | 130.30±19.45 | 136.50±25.39 | 0.891 | 0.377 |
| 舒张压/mmHg | 70.90±8.73 | 72.90±9.27 | 1.876 | 0.067 |
| 总胆固醇/(mmol/L) | 4.42±1.11 | 4.75±1.15 | 1.004 | 0.321 |
| HDL-C/(mmol/L) | 1.07±0.30 | 0.94±0.19 | 1.707 | 0.094 |
| LDL-C/(mmol/L) | 2.57±0.99 | 2.90±0.83 | 1.283 | 0.206 |
| 甘油三酯/(mmol/L) | 1.50±0.73 | 1.97±1.00 | 1.869 | 0.068 |
| 尿素氮/(mmol/L) | 5.65±2.15 | 5.27±1.26 | 0.773 | 0.443 |
| eGFR/[mL/(min·1.73m2)] | 63.80±21.06 | 65.56±14.27 | 0.336 | 0.738 |
| GHbA1c/% | 6.25±1.06 | 6.28±1.09 | 0.108 | 0.914 |
| cTnⅠ/(ng/mL) | 1.62±0.04 | 122.00±18.67 | 4.177 | <0.001 |
| BNP/(pg/mL) | 135.00±13.67 | 550.00±21.34 | 4.531 | <0.001 |
| Elabela/(ng/mL) | 71.89±8.90 | 92.04±23.14 | 4.141 | <0.001 |
注:eGFR为估算肾小球滤过率;BNP为B型脑钠肽; 1 mmHg = 0.133 kPa。 |
二、H2O2处理后Elabela表达增加
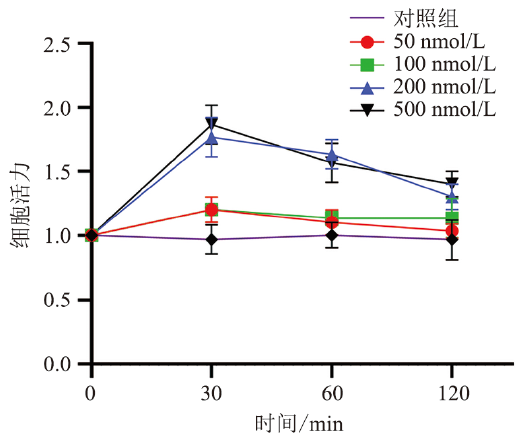
三、ELA-32预处理增强H9C2细胞活力
四、ELA-32预处理保护H9C2细胞免受H2O2诱导的细胞损伤
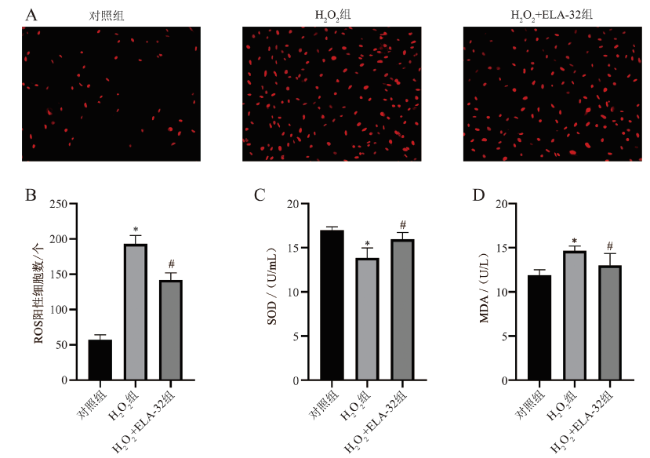
五、ELA-32预处理减少H2O2诱导的氧化应激损伤
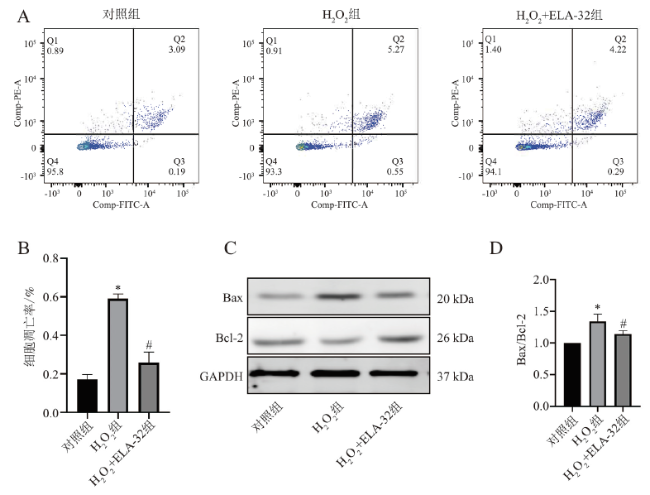
六、ELA-32减少H2O2诱导的H9C2细胞凋亡
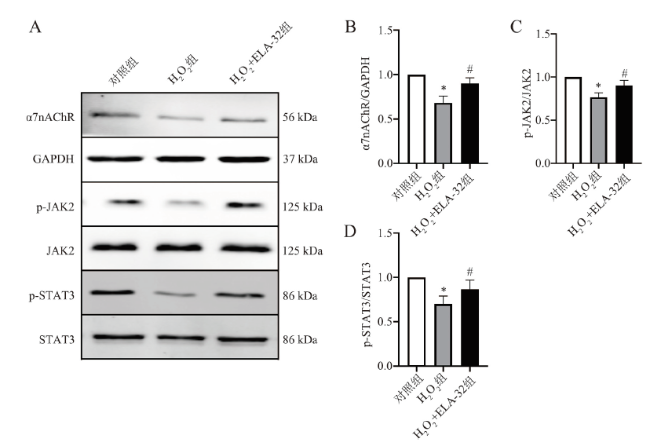
七、ELA-32对α7nAChR/JAK2/STAT3通路的影响
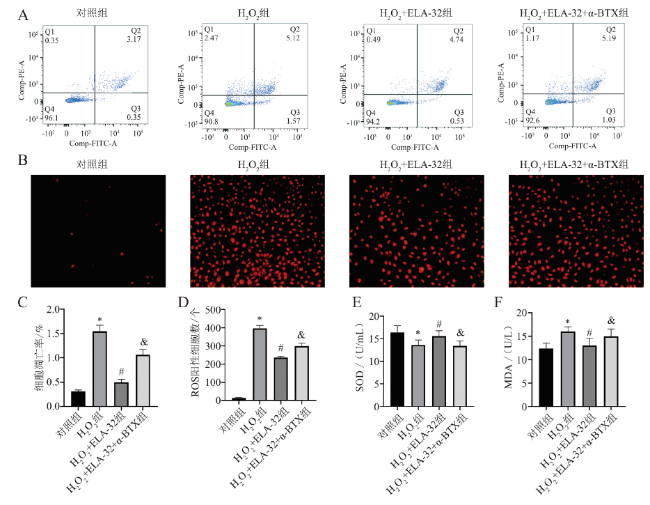
八、ELA-32通过α7nAChR介导的JAK2/STAT3途径抑制H2O2诱导的H9C2细胞损伤
图5 Elabela通过α7nAChR/JAK2/STAT3信号通路发挥心肌保护的作用注:A、C为α-BTX逆转Elabela的抗凋亡作用, 与对照组比较, *P < 0.001, 与H2O2组比较, #P < 0.001, 与ELA-32组比较, &P < 0.001, F = 168.196, n = 6;B、D为荧光显微镜下ROS阳性细胞数的比较(DHE染色, ×100), 与对照组比较, *P < 0.001, 与H2O2组比较, #P < 0.001, 与ELA-32组比较, &P = 0.002, F = 491.924, n = 5;E为α-BTX降低Elabela升高的SOD水平, 与对照组比较, *P < 0.001, 与H2O2组比较, #P < 0.001, 与ELA-32组比较, &P < 0.001, F =20.116, n = 5;F为α-BTX升高Elabela降低的MDA水平, 与对照组比较, *P < 0.001, 与H2O2组比较, #P < 0.001, 与ELA-32组比较, &P = 0.013, F = 25.706, n = 5。 |