材料与方法
一、试剂与耗材
二、方法
1. MSC的分离培养
2. MSC的多向分化能力鉴定
3. MSC的流式细胞术鉴定
4.细胞培养上清的获取
5.细胞因子的芯片检测
6.差异表达蛋白(DEP)筛选及KEGG通路富集分析
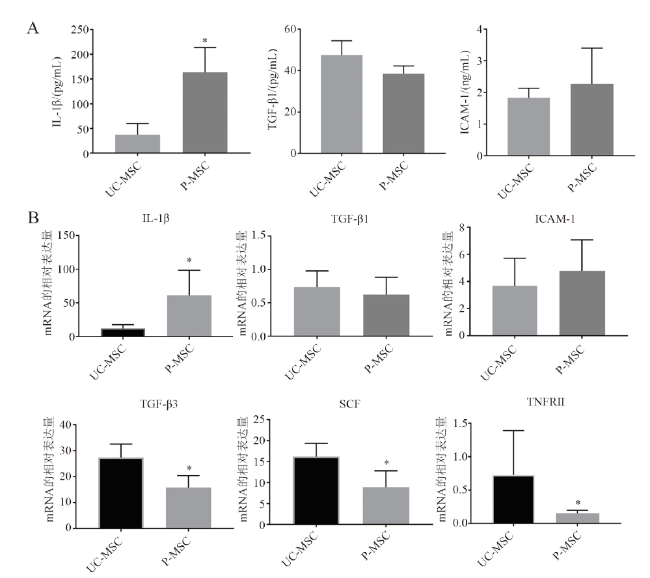
7. ELISA检测细胞因子的表达
8.实时PCR(RT-PCR)检测相关基因的表达
表1 引物列表 |
| 基因 | 引物序列 |
|---|---|
| IL-1β | 上游:5′ -ATGATGGCTTATTACAGTGGCAA-3′ |
| 下游:5′ -GTCGGAGATTCGTAGCTGGA -3′ | |
| TGF-β1 | 上游:5′ -GGCCAGATCCTGTCCAAGC -3′ |
| 下游:5′ -GTGGGTTTCCACCATTAGCAC -3′ | |
| ICAM-1 | 上游:5′ -ATGCCCAGACATCTGTGTCC -3′ |
| 下游:5′ -GGGGTCTCTATGCCCAACAA -3′ | |
| TGF-β3 | 上游:5′ -ACTTGCACCACCTTGGACTTC -3′ |
| 下游:5′ -GGTCATCACCGTTGGCTCA -3′ | |
| SCF | 上游:5′ -AATCCTCTCGTCAAAACTGAAGG-3′ |
| 下游:5′ -CCATCTCGCTTATCCAACAATGA-3′ | |
| TNFRⅡ | 上游:5′ -TGAAACATCAGACGTGGTGTG -3′ |
| 下游:5′ -TGCAAATATCCGTGGATGAAGTC-3′ | |
| β-actin | 上游:5′ -TGACGTGGACATCCGCAAAG -3′ |
| 下游:5′ -CTGGAAGGTGGACAGCGAGG -3′ |
注:TNFRⅡ为TNF受体Ⅱ。 |
三、统计学处理
结果
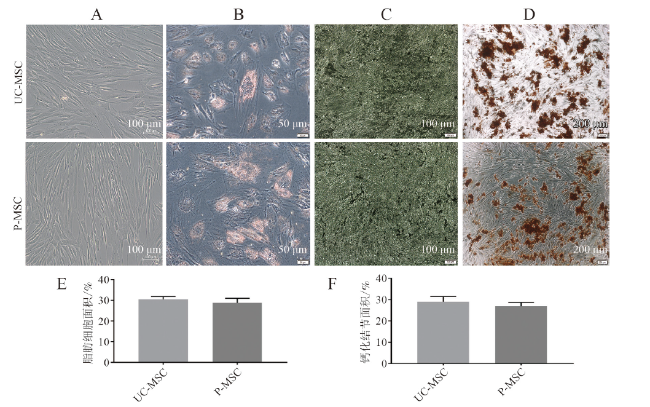
一、MSC分化能力比较
表2 流式细胞术检测MSC的表面标志物表达(n = 7) |
| 表面标志 | UC-MSC/% | P-MSC/% | t值 | P值 |
|---|---|---|---|---|
| CD13 | 98.5±0.5 | 97.1±1.3 | 1.483 | 0.189 |
| CD34 | 0.5±0.2 | 0.6±0.4 | 0.379 | 0.718 |
| CD44 | 99.1±0.1 | 98.4±0.8 | 2.162 | 0.074 |
| CD45 | 0.9±0.2 | 0.7±0.1 | 1.274 | 0.250 |
| CD73 | 98.4±1.2 | 99.4±0.1 | 0.525 | 0.627 |
| CD90 | 98.6±1.1 | 99.1±0.5 | 0.967 | 0.371 |
| CD105 | 99.3±0.7 | 97.4±1.2 | 0.694 | 0.514 |
| HLA-DR | 0.2±0.2 | 0.4±0.1 | 0.058 | 0.956 |
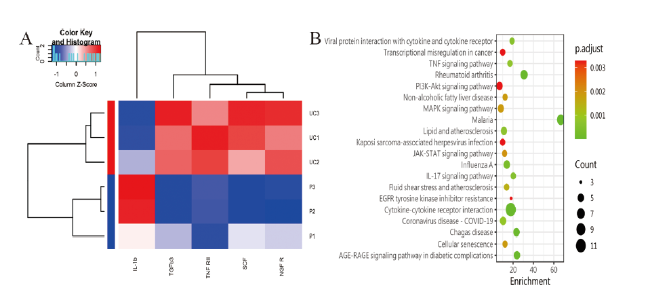
二、UC-MSC和P-MSC细胞因子分泌的表达
表3 芯片检测MSC细胞因子表达前10位(n = 3) 单位:pg/mL |
| 细胞因子 | UC-MSC | P-MSC | t值 | P值 |
|---|---|---|---|---|
| IGFBP-4 | 37 055.57±8796.19 | 18 080.46±10 064.16 | 1.716 | 0.349 |
| IGFBP-3 | 27 469.17±36214.59 | 3645.21±695.46 | 1.294 | 0.453 |
| TIMP-2 | 15 360.29±2620.63 | 15 461.46±969.15 | 0.128 | 0.993 |
| TIMP-1 | 9350.68±994.88 | 8461.25±551.02 | 0.902 | 0.565 |
| IGFBP-6 | 5321.42±3323.29 | 920.78±1026.85 | 2.968 | 0.101 |
| TGF-β1 | 3750.31±1025.46 | 19 306.43±8600.49 | 0.835 | 0.576 |
| HGF | 2960.84±3906.31 | 267.88±213.47 | 1.932 | 0.305 |
| IL-6 | 2296.71±1320.84 | 8312.69±4705.07 | 2.226 | 0.563 |
| MCP-1 | 2280.96±204.74 | 3019.93±1110.99 | 1.099 | 0.505 |
| ICAM-1 | 1658.30±747.70 | 8981.43±5870.13 | 2.980 | 0.101 |
表4 芯片检测MSC细胞因子表达后10位(n = 3) 单位:pg/mL |
| 细胞因子 | UC-MSC | P-MSC | t值 | P值 |
|---|---|---|---|---|
| EGF | 0.28±0.18 | 0.10±0.11 | 1.309 | 0.453 |
| IL-17 | 0.23±0.40 | 0 | 0.565 | 0.883 |
| IL-12p40 | 0.23±0.40 | 0.24±0.42 | 0.026 | 1.000 |
| BLC | 0.16±0.16 | 0.03±0.03 | 1.106 | 0.505 |
| TNF-β | 0 | 0 | 0.000 | 1.000 |
| IL-13 | 0 | 0 | 0.000 | 1.000 |
| MIP-1δ | 0 | 0.24±0.42 | 1.624 | 0.565 |
| Eotaxin-2 | 0 | 0 | 0.000 | 1.000 |
| IL-12p70 | 0 | 0 | 0.000 | 1.000 |
| PDGF-BB | 0 | 0 | 0.000 | 1.000 |