对象与方法
一、研究对象
二、方法
1. 治疗方法
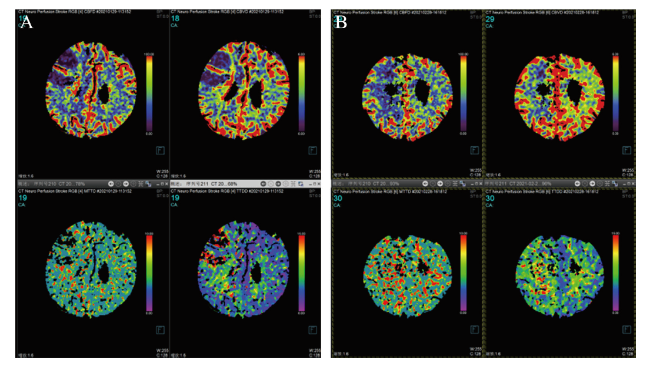
2. CTP检查方法
3. 检测指标
4. 康复评估指标
三、统计学处理
结果
一、治疗组与对照组缺血性脑卒中患者的一般资料比较
表1 治疗组与对照组缺血性脑卒中患者的一般资料比较 |
| 组 别 | 例数 | 年龄/岁 | 性别/例(%) | 治疗前NIHSS评分/例(%) | |||
|---|---|---|---|---|---|---|---|
| 男 | 女 | 7~15分 | 16~20分 | ||||
| 治疗组 | 29 | 56.90±10.64 | 17(59) | 12(41) | 14(48) | 15(52) | |
| 对照组 | 26 | 58.15±10.08 | 17(65) | 9(35) | 14(54) | 12(46) | |
| t/χ2值 | 0.448 | 0.266 | 0.170 | ||||
| P值 | 0.656 | 0.606 | 0.680 | ||||
二、治疗组与对照组缺血性脑卒中患者的CTP指标比较
表2 治疗组与对照组缺血性脑卒中患者的CTP指标比较( $\bar{x}±s$) |
| 组 别 | 例数 | CBF/[mL/(100 g·min)] | CBV/(mL/100 g) | TTP/s | MMT/s | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 入院第30日 | 治疗前 | 入院第30日 | 治疗前 | 入院第30日 | 治疗前 | 入院第30日 | |||||
| 治疗组 | 29 | 25.9±12.1 | 36.0±10.9a | 2.00±1.01 | 2.48±1.04a | 19.1±6.5 | 14.3±4.9a | 4.51±1.30 | 3.30±0.89a | |||
| 对照组 | 26 | 27.1±10.4 | 29.3±9.6a | 1.85±0.64 | 1.93±0.62 | 19.8±5.5 | 17.2±4.8a | 4.36±1.09 | 3.88±0.97a | |||
| t值 | 0.383 | 2.469 | 0.649 | 2.347 | 0.452 | 2.226 | 0.461 | 2.313 | ||||
| P值 | 0.703 | 0.020 | 0.519 | 0.023 | 0.653 | 0.030 | 0.647 | 0.025 | ||||
注:与治疗前比较,aP < 0.05。 |
三、治疗前后治疗组与对照组缺血性脑卒中患者的血清学指标水平比较
表3 治疗前后2组缺血性脑卒中患者的血清VEGF、HIF-1α、Ang-1水平比较( $\bar{x}±s$) 单位:ng/L |
| 组 别 | 例数 | VEGF | HIF-1α | Ang-1 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗 第14日 | 入院 第30日 | 治疗前 | 治疗 第14日 | 入院 第30日 | 治疗前 | 治疗 第14日 | 入院 第30日 | ||||
| 治疗组 | 29 | 735±166 | 996±166a | 821±176b | 975±231 | 723±178a | 358±113ab | 21.9±5.4 | 38.0±8.9a | 26.6±5.9ab | ||
| 对照组 | 26 | 712±166 | 801±184 | 751±170 | 916±252 | 616±195a | 354±121ab | 23.0±5.4 | 29.7±6.1a | 22.4±4.9b | ||
| t值 | 0.529 | 4.131 | 1.496 | 0.907 | 2.132 | 0.155 | 0.738 | 4.016 | 2.820 | |||
| P值 | 0.599 | <0.001 | 0.141 | 0.309 | 0.038 | 0.877 | 0.464 | <0.001 | 0.007 | |||
注:与治疗前比较,aP < 0.017;与治疗第14日比较,bP < 0.017。 |
四、治疗期间治疗组与对照组缺血性脑卒中患者的康复评分比较
表4 治疗组与对照组缺血性脑卒中患者的NIHSS、BI评分比较( $\bar{x}±s$) 单位:分 |
| 组 别 | 例数 | NIHSS评分 | BI评分 | |||||
|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗第14日 | 入院第30日 | 治疗前 | 治疗第14日 | 入院第30日 | |||
| 治疗组 | 29 | 15.3±3.1 | 8.7±1.9a | 5.8±1.6ab | 26.9±9.8 | 52.8±10.7a | 70.7±10.9ab | |
| 对照组 | 26 | 15.3±3.2 | 11.2±2.5a | 8.1±1.6ab | 30.4±8.8 | 43.7±10.2a | 65.2±7.1ab | |
| t值 | 0.047 | 4.308 | 5.549 | 1.380 | 3.179 | 2.183 | ||
| P值 | 0.963 | <0.001 | <0.001 | 0.173 | 0.002 | 0.034 | ||
注:与治疗前比较,aP < 0.017;与治疗第14日比较,bP < 0.017。 |