对象与方法
一、研究对象
二、方法
1. 临床资料收集
2. 免疫组织化学(免疫组化)染色法检测
三、统计学处理
结果
一、研究对象的基本信息
二、Cx32、Src/FAK蛋白在肝癌组织以及相应的癌旁组织中的表达情况
表1 97例肝癌组织以及相应的癌旁组织中Cx32、Src/FAK蛋白的表达情况[例(%)] |
| 蛋 白 | 肝癌组织 | 癌旁组织 | 合计 | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 表达 | 不表达 | |||||
| Cx32 | 表达 | 47(48) | 1(1) | 48(49) | ||
| 不表达 | 31(32) | 18(19) | 49(51) | |||
| 合计 | 78(80) | 19(20) | 28.125 | <0.001 | ||
| p-Src Y416 | 表达 | 8(8) | 48(49) | 56(58) | ||
| 不表达 | 0(0) | 41(42) | 41(42) | |||
| 合计 | 8(8) | 89(92) | 48.000 | <0.001 | ||
| Total Src | 表达 | 11(11) | 54(56) | 65(67) | ||
| 不表达 | 1(1) | 40(41) | 32(33) | |||
| 合计 | 12(12) | 85(88) | 51.073 | <0.001 | ||
| p-FAK Y925 | 表达 | 9(9) | 49(51) | 58(60) | ||
| 不表达 | 0(0) | 39(40) | 39(40) | |||
| 合计 | 9(9) | 88(91) | 49.000 | <0.001 | ||
| Total FAK | 表达 | 10(10) | 52(54) | 62(64) | ||
| 不表达 | 0(0) | 35(36) | 35(36) | |||
| 合计 | 10(10) | 87(90) | 52.000 | <0.001 | ||
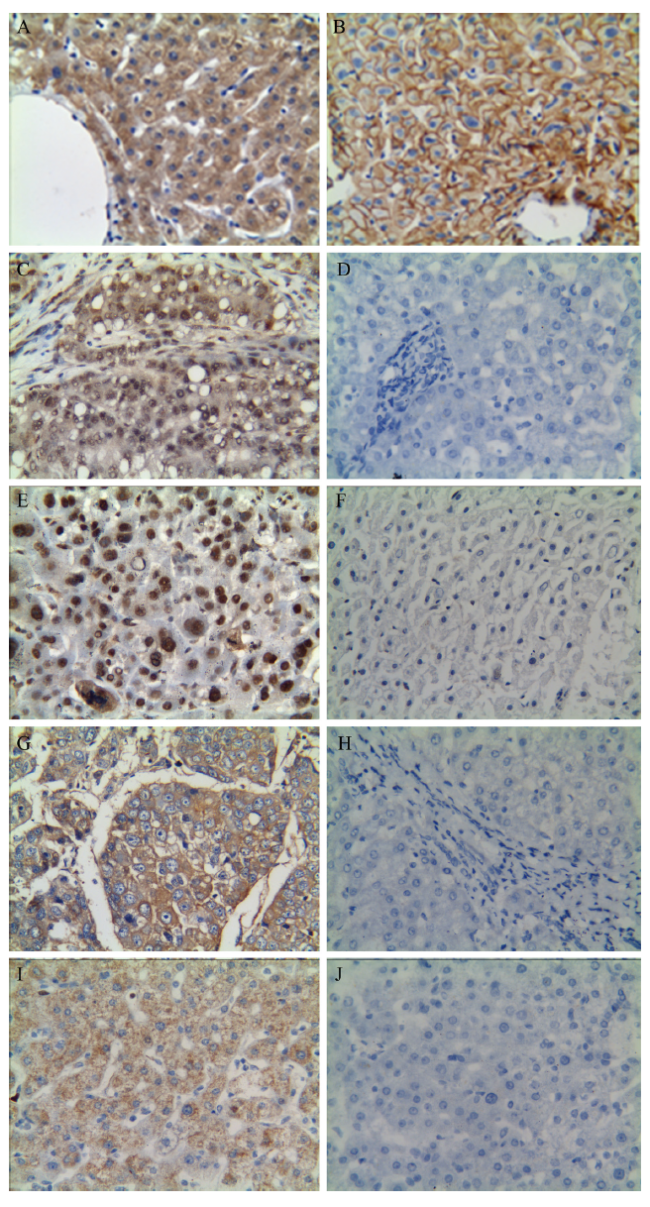
图1 肝癌组织与癌旁组织的Cx32、p-Src Y416、p-FAK Y925、total Src、total FAK蛋白表达比较(免疫组化染色,×200)注:A为肝癌组织Cx32蛋白表达,B为癌旁组织Cx32蛋白表达;C为肝癌组织p-Src Y416蛋白表达,D为癌旁组织p-Src Y416蛋白表达;E为肝癌组织p-FAK Y925蛋白表达,F为癌旁组织p-FAK Y925蛋白表达;G为肝癌组织total Src蛋白表达,H为癌旁组织total Src蛋白表达;I为肝癌组织total FAK蛋白表达,J为癌旁组织total FAK蛋白表达。 |
表2 97例肝癌组织以及相应的癌旁组织中Cx32、Src/FAK蛋白的具体表达情况[例(%)] |
| 蛋 白 | 肝癌组织 | 癌旁组织 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| - | + | ++ | +++ | ++++ | 低表达率 | 高表达率 | - | + | ++ | +++ | ++++ | 低表达率 | 高表达率 | ||
| Cx32 | 49 | 19 | 9 | 20 | 0 | (70) | (30) | 19 | 3 | 20 | 42 | 13 | (23) | (77) | |
| p-Src Y416 | 41 | 6 | 35 | 11 | 4 | (48) | (52) | 89 | 5 | 2 | 1 | 0 | (97) | (3) | |
| Total Src | 32 | 12 | 34 | 17 | 2 | (45) | (55) | 85 | 10 | 2 | 0 | 0 | (98) | (2) | |
| p-FAK Y925 | 39 | 6 | 43 | 8 | 1 | (46) | (54) | 88 | 8 | 1 | 0 | 0 | (99) | (1) | |
| Total FAK | 35 | 13 | 32 | 14 | 3 | (49) | (51) | 87 | 10 | 0 | 0 | 0 | (100) | (0) | |
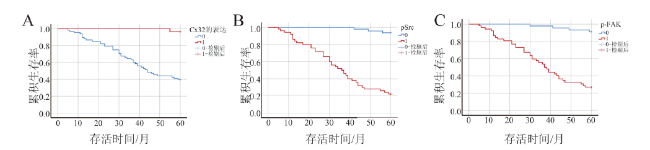
三、97例肝癌根治性术后患者死亡的单因素和多因素Cox回归分析结果
表3 97例肝癌患者单因素和多因素分析结果 |
| 影响因素 | 单因素分析 | 多因素分析 | |||
|---|---|---|---|---|---|
| HR (95%CI) | P值 | HR (95%CI) | P值 | ||
| 年龄 | 1.041(1.009,1.075) | 0.013 | 1.057(1.015,1.1) | 0.007 | |
| 性别(男vs. 女) | 0.714(0.371,1.376) | 0.314 | 1.100(0.47,2.578) | 0.826 | |
| 甲胎蛋白 (> 400 μg/L vs.≤400 μg/L) | 1.807(0.969,3.372) | 0.063 | 1.479(0.698,3.133) | 0.307 | |
| 乙型肝炎(有vs.无) | 0.923(0.486,1.753) | 0.806 | 1.443(0.485,4.287) | 0.510 | |
| 分化程度 中分化vs. 低分化 高分化vs. 低分化 | 0.247(0.097,0.633) 0.141(0.072,0.276) 0.170(0.056,0.517) | 0.004 <0.001 0.002 | 0(0,0) 0.345(0.152,0.783) 0.381(0.097,1.493) | 0.036 0.011 0.166 | |
| 有无包膜(有包膜vs. 无包膜) | 0.399(0.142,1.119) | 0.081 | 2.168(0.564,8.333) | 0.260 | |
| 肿瘤长径(> 5 cm vs. ≤5 cm) | 2.162(1.121,4.166) | 0.021 | 1.110(0.455,2.707) | 0.819 | |
| Cx32(低表达vs.高表达) | 0.038(0.005,0.275) | 0.001 | 0.120(0.015,0.997) | 0.049 | |
| p-Src Y416(高表达vs.低表达) | 23.532(7.219,76.706) | <0.001 | 14.306(3.36,60.901) | <0.001 | |
| total Src(高表达vs.低表达) | 29.546(7.099,122.974) | <0.001 | 6.504(1.051,40.248) | 0.044 | |
| p-FAK Y925(高表达vs.低表达) | 14.415(5.113,40.636) | <0.001 | 12.152(2.746,53.783) | 0.001 | |
| total FAK(高表达vs.低表达) | 12.012(4.686,30.796) | <0.001 | 2.434(0.674,8.793) | 0.175 | |