对象与方法
一、研究对象
二、临床资料收集
三、关节炎自我效能感问卷调查
四、统计学处理
结果
一、门诊RA患者的基本特征
二、门诊RA患者自我效能感的特征
表1 RA患者的自我效能感与各变量的相关分析 |
| 变 量 | Spearman 相关分析 | 点二列相关分析 | ||
|---|---|---|---|---|
| 相关系数 | P值 | 相关系数 | P值 | |
| 性别-女 | — | — | 0.02 | 0.634 |
| 年龄 | -0.10 | 0.036 | — | — |
| 病程 | -0.05 | 0.348 | — | — |
| 专科随诊时长 | 0.10 | 0.045 | — | — |
| 参加RA病友会-是 | — | — | 0.15 | 0.003 |
| 28TJC | -0.43 | <0.001 | — | — |
| 28SJC | -0.28 | <0.001 | — | — |
| PtGA | -0.55 | <0.001 | — | — |
| PrGA | -0.55 | <0.001 | — | — |
| VAS | -0.50 | <0.001 | — | — |
| HAQ-DI | -0.44 | <0.001 | — | — |
| ESR | -0.13 | 0.009 | — | — |
| CRP | -0.10 | 0.053 | — | — |
| RF-阳性 | — | — | 0.06 | 0.258 |
| 抗CCP-阳性 | — | — | 0.03 | 0.614 |
| SDAI | -0.53 | <0.001 | — | — |
| mTSS | -0.13 | 0.014 | — | — |
| 既往6个月用药 | ||||
| 糖皮质激素-是 | — | — | -0.19 | <0.001 |
| 传统DMARD-是 | — | — | — | — |
| 生物制剂-是 | — | — | <0.01 | 0.976 |
注:—为无数据。 |
三、RA患者自我效能感的相关因素分析
1. 单因素分析
表2 门诊RA患者的自我效能感影响因素单因素线性回归分析 |
| 变 量 | B(95%CI) | β值 | P值 |
|---|---|---|---|
| 女性 | 1.14(-3.57~5.85) | 0.02 | 0.634 |
| 年龄 | -0.15(-0.28~-0.02) | -0.12 | 0.021 |
| 病程 | -0.01(-0.03~0.01) | -0.04 | 0.422 |
| 专科就医随诊时长 | 0.11(0.01~0.22) | 0.11 | 0.034 |
| 参加RA病友会 | 4.97(1.69~8.25) | 0.15 | 0.003 |
| 28TJC | -1.33(-1.75~-0.92) | -0.30 | <0.001 |
| 28SJC | -1.21(-1.81~-0.61) | -0.19 | <0.001 |
| PtGA | -3.73(-4.33~-3.12) | -0.52 | <0.001 |
| PrGA | -3.95(-4.59~-3.32) | -0.52 | <0.001 |
| VAS | -4.54(-5.33~-3.75) | -0.49 | <0.001 |
| HAQ-DI | -18.73(-22.78~-14.69) | -0.42 | <0.001 |
| ESR | -0.12(-0.21~-0.04) | -0.14 | 0.004 |
| CRP | -0.24(-0.38~-0.09) | -0.16 | 0.002 |
| RF阳性 | 1.96(-1.44~5.36) | 0.06 | 0.258 |
| 抗CCP阳性 | 0.92(-2.66~4.49) | 0.03 | 0.614 |
| SDAI | -0.77(-0.92~-0.61) | -0.44 | <0.001 |
| mTSS | -0.06(-0.11~-0.01) | -0.13 | 0.013 |
| 既往6个月用药 | |||
| 糖皮质激素 | -6.65(-9.98~-3.32) | -0.19 | <0.001 |
| 传统DMARD | — | — | — |
| 生物制剂 | 0.10(-6.50~6.71) | 0.00 | 0.976 |
注:—为无数据。 |
2. 多因素分析
表3 RA患者的自我效能感影响因素多重线性回归分析 |
| 变 量 | 模型1 | 模型1+交互作用 | ||||
|---|---|---|---|---|---|---|
| B(95%CI) | β值 | P值 | B(95%CI) | β值 | P值 | |
| 常数项 | 68.16(65.57~70.74) | — | <0.001 | 63.11(58.42~67.81) | — | <0.001 |
| PtGA | -1.94(-2.90~-0.98) | -0.27 | <0.001 | -1.95(-2.91~-0.99) | -0.27 | <0.001 |
| 疼痛VAS | -1.97(-3.14~-0.80) | -0.21 | 0.001 | -0.20(-1.91~1.50) | -0.02 | 0.813 |
| HAQ-DI | -5.19(-9.96~-0.43) | -0.12 | 0.033 | -5.39(-10.12~-0.66) | -0.12 | 0.026 |
| 糖皮质激素-是 | -4.28(-7.12~-1.43) | -0.12 | 0.003 | -3.59(-6.50~-0.67) | -0.10 | 0.016 |
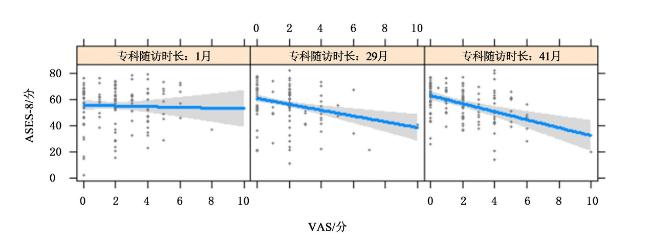
| 专科随诊时长 | — | — | — | 0.18(0.04~0.32) | 0.17 | 0.010 |
| 疼痛VAS×专科随诊时长 | — | — | — | -0.07(-0.12~-0.02) | -0.25 | 0.005 |
| R2 | 0.318 | 0.332 | ||||
| 调整R2 | 0.311 | 0.322 | ||||
注:R2为决定系数。 |