材料与方法
一、材料
1.实验动物
2.主要试剂
二、方法
1.动物分组及干预方法
2. TBI模型建立
3.行为学检测
4. ELISA检测
5.免疫荧光检测
6.蛋白免疫印迹法检测
三、统计学处理
结果
一、IL-18BP对TBI大鼠焦虑样行为的影响
表1 大鼠术后第30日旷场实验结果$(\bar{x} \pm s)$ |
| 组 别 | 只数 | 运动距离/m | 中央区进入次数/次 | 中央区活动时间/s |
|---|---|---|---|---|
| Sham组 | 12 | 12.22±0.73 | 51.08±6.76 | 56.33±4.45 |
| TBI组 | 12 | 12.29±0.80 | 24.08±3.63a | 24.33±3.55a |
| TBI+IL-18BP组 | 12 | 12.16±0.67 | 36.83±4.37b | 38.25±3.28b |
| F值 | 0.017 | 84.250 | 174.700 | |
| P值 | 0.983 | <0.001 | <0.001 |
注:与Sham组相比,aP < 0.05; 与TBI组相比,bP < 0.05。 |
表2 大鼠术后第30日高架十字迷宫结果$(\bar{x} \pm s)$ |
| 组 别 | 只数 | 运动距离/m | 开放臂进入次数百分比/% | 开放臂运动时间百分比/% |
|---|---|---|---|---|
| Sham组 | 12 | 28.95±3.05 | 54.83±3.54 | 32.33±2.77 |
| TBI组 | 12 | 29.61±3.30 | 20.83±4.24a | 11.25±2.14a |
| TBI+IL-18BP组 | 12 | 30.24±2.56 | 39.08±3.70b | 19.67±2.71b |
| F值 | 0.559 | 235.800 | 206.900 | |
| P值 | 0.577 | <0.001 | <0.001 |
注:与Sham组相比,aP < 0.05; 与TBI组相比,bP < 0.05。 |
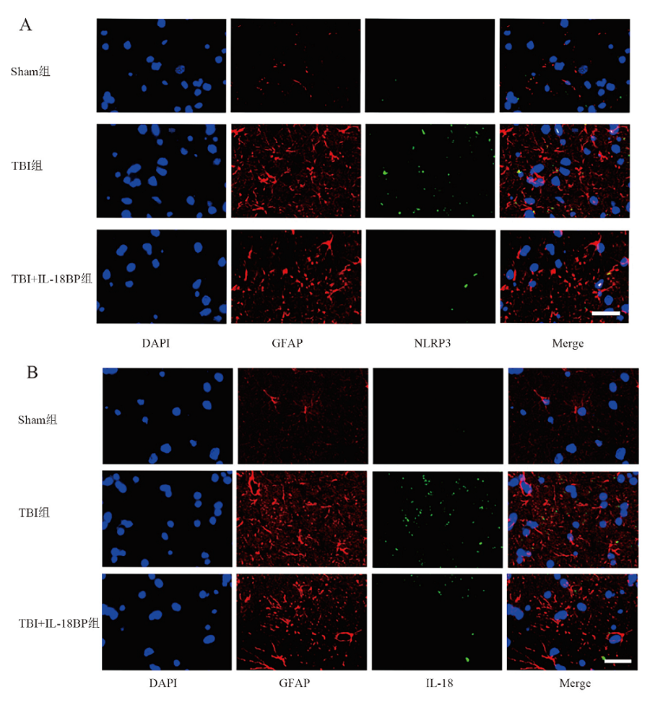
二、大鼠杏仁核区神经元、星形胶质细胞数量变化
三、大鼠血清、脑脊液中IL-18的浓度
表3 大鼠术后第30日血清和脑脊液中的IL-18浓度$(\bar{x} \pm s)$ 单位:ng/mL |
| 组 别 | 只数 | 血清IL-18 | 脑脊液IL-18 |
|---|---|---|---|
| Sham组 | 12 | 106.56±8.32 | 99.75±7.25 |
| TBI组 | 12 | 265.35±21.43a | 249.30±18.50a |
| TBI+IL-18BP组 | 12 | 204.15±14.54b | 196.10±11.84b |
| F值 | 311.500 | 386.500 | |
| P值 | <0.001 | <0.001 |
注:与Sham组相比,aP < 0.05; 与TBI组相比,bP < 0.05。 |