材料与方法
一、材料
二、方法
1. 生物信息学分析
2. RNF187 mRNA在前列腺癌不同细胞系中表达水平的检测
3. RWPE-1、LNCaP、C4-2、PC-3、DU145细胞培养及细胞转染
4. 转染后细胞增殖活性检测
5. RNF187敲减对细胞增殖能力影响的验证
6. RNF187敲减对细胞侵袭与迁移能力影响的检测
7. RNF187敲减对EMT标志蛋白和MMP-9表达的影响
三、统计学处理
结果
一、TCGA和GEO数据库中RNF187转录水平的差异表达分析结果
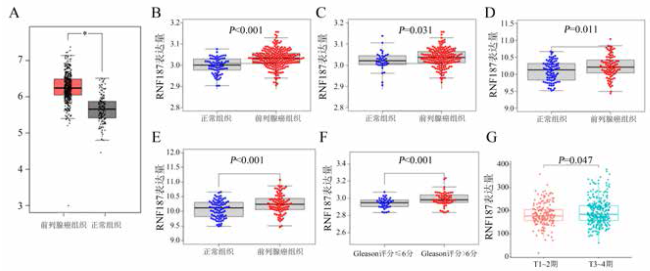
图1 TCGA和GEO数据库中前列腺癌RNF187转录水平的差异表达分析注:A为TCGA-PRAD数据集中前列腺癌组织(n = 492)与正常组织(n = 152)的RNF187表达量比较,*P < 0.001;B为GEO6919数据集中前列腺癌组织(n = 271)与正常组织(n = 74)的RNF187表达量比较;C为GEO32571数据集中前列腺癌组织(n = 254)与正常组织(n = 37)的RNF187表达量比较;D为GEO6919数据集中前列腺癌组织(n = 271)与正常组织(n = 74)的RNF187表达量比较;E为GEO70770数据集中前列腺癌组织(n = 81)与正常组织(n = 90)的RNF187表达量比较;F为TCGA-PRAD数据集中Gleason评分>6分(n = 59)与≤6分(n = 39)的前列腺癌组织RNF187表达量比较;G为TCGA-PRAD数据集中T1~2期(n = 327)与T3~4期(n = 504)前列腺癌组织的RNF187表达量比较。 |
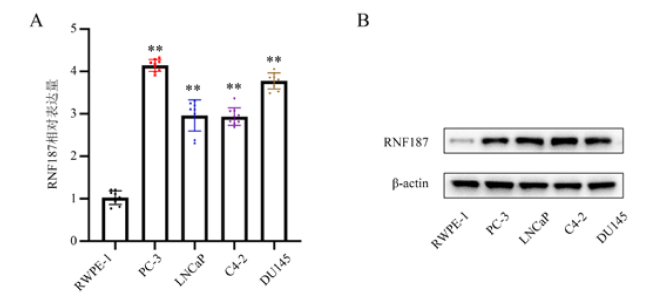
二、RNF187在正常前列腺上皮细胞及前列腺癌细胞中的表达
三、RNF187敲减对前列腺癌细胞DU145和PC-3增殖能力的影响
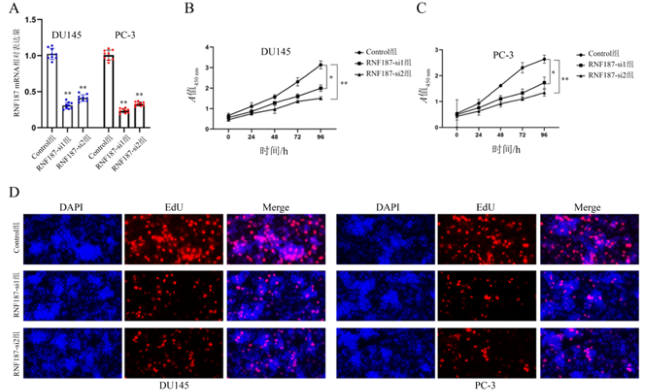
图3 RNF187敲减对DU145和PC-3增殖能力的影响注:A为RNF187 敲减后RNF187 mRNA相对表达量的变化(n=9);B、C为RNF187敲减后,CCK-8检测PC-3和DU145的增殖活性变化(n=15);D为EdU检测RNF187敲减对前列腺癌PC-3和DU145增殖能力的影响(×20);与Control组比较,**P < 0.01。 |
表1 RNF187敲减对PC-3和DU145 EdU阳性率的影响($\bar{x} \pm s$) 单位:% |
| 组 别 | DU145 | PC-3 |
|---|---|---|
| Control组 | 73.14±2.27 | 69.17±3.24 |
| RNF187-si1组 | 24.12±4.15 | 14.38±2.12 |
| RNF187-si2组 | 26.58±2.34 | 15.02±2.36 |
| P值 | 0.007 | 0.008 |
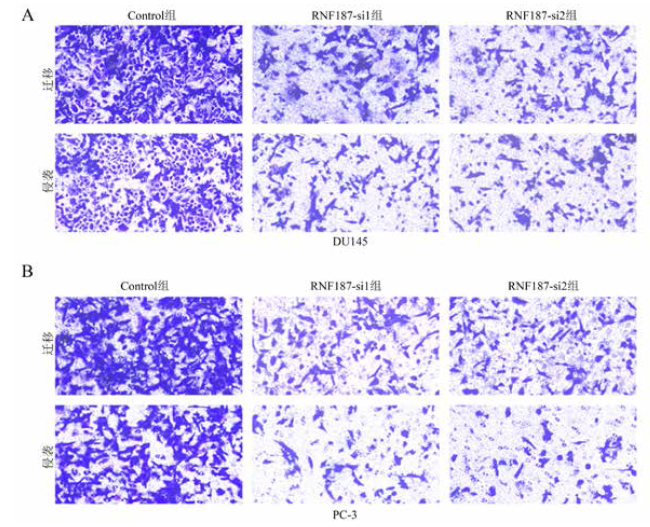
四、RNF187敲减对前列腺癌细胞PC-3和DU145侵袭与迁移能力的影响
表2 RNF187敲减对PC-3和DU145侵袭与迁移能力的影响($\bar{x} \pm s$) |
| 组 别 | DU145 | PC-3 | |||
|---|---|---|---|---|---|
| 迁移细胞数 | 侵袭细胞数 | 迁移细胞数 | 侵袭细胞数 | ||
| Control组 | 615±15 | 579±14 | 514±17 | 427±9 | |
| RNF187-si1组 | 191±14 | 87±10 | 183±9 | 84±7 | |
| RNF187-si2组 | 177±5 | 102±7 | 199±8 | 98±3 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |
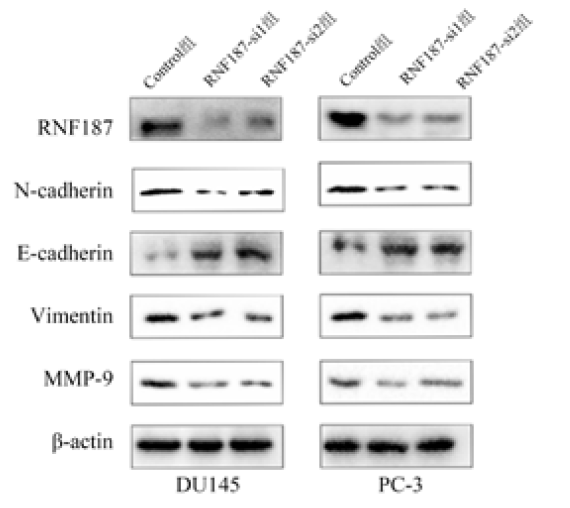
五、RNF187敲减对前列腺癌细胞DU145、PC-3中RNF187和EMT标志蛋白表达的影响
表3 RNF187敲减对DU145、PC-3中RNF187和EMT标志蛋白相对表达量的影响($\bar{x} \pm s$) |
| 组 别 | RNF187 | N-cadherin | Vimentin | MMP-9 | E-cadherin |
|---|---|---|---|---|---|
| DU145 | |||||
| Control组 | 1.28±0.05 | 0.37±0.05 | 0.44±0.15 | 0.37±0.07 | 0.39±0.15 |
| RNF187-si1组 | 0.72±0.14 | 0.12±0.03 | 0.31±0.09 | 0.21±0.05 | 0.91±0.09 |
| RNF187-si2组 | 0.63±0.07 | 0.22±0.04 | 0.23±0.07 | 0.16±0.05 | 1.04±0.08 |
| P值 | 0.019 | 0.031 | 0.027 | 0.024 | 0.021 |
| PC-3 | |||||
| Control组 | 1.35±0.15 | 0.45±0.08 | 0.56±0.15 | 0.35±0.20 | 0.78±0.14 |
| RNF187-si1组 | 0.72±0.10 | 0.11±0.08 | 0.22±0.09 | 0.14±0.03 | 0.91±0.11 |
| RNF187-si2组 | 0.63±0.09 | 0.17±0.06 | 0.16±0.12 | 0.26±0.08 | 0.79±0.13 |
| P值 | 0.012 | 0.032 | 0.021 | 0.033 | 0.027 |