1 甲状腺乳头状癌的定义和流行病学
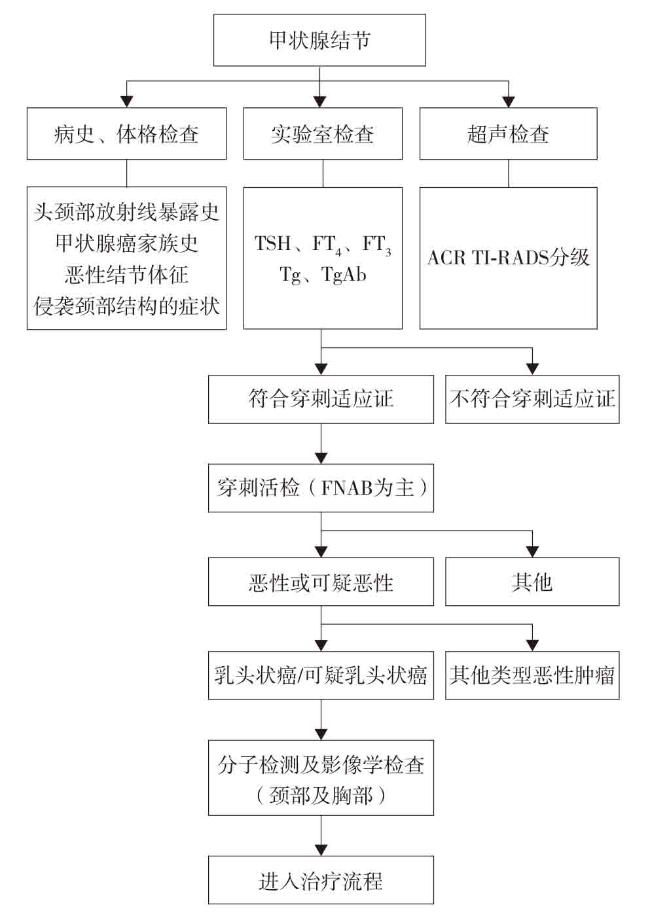
2 甲状腺乳头状癌的术前诊断流程
2.1 临床表现
2.2 实验室检查
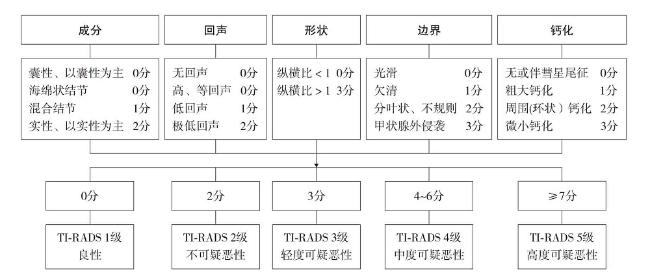
2.3 超声检查
2.4 穿刺活组织检查
2.4.1 超声引导下细针穿刺活检的适应证
2.4.2 超声引导下淋巴结穿刺活检适应证
2.4.3 超声引导下穿刺活检禁忌证
2.5 增强计算机断层扫描/磁共振成像
2.6 其他影像学检查
2.7 细针穿刺病理报告
表1 2023年TBSRTC诊断分类Table 1 TBSRTC diagnostic classification of 2023 |
| 诊断分类 | 具体内容 |
|---|---|
| Ⅰ.标本不能诊断 | 只有囊液成分 |
| 几乎无上皮细胞 | |
| 其他(血液遮盖、血凝块、人工干燥等) | |
| Ⅱ.良性 | 符合滤泡结节状病变(包括腺瘤样结节、胶质结节等) |
| 符合慢性淋巴细胞性(桥本)甲状腺炎 | |
| 符合肉芽肿性(亚急性)甲状腺炎 | |
| 其他 | |
| Ⅲ.意义不明确 | 滤泡上皮细胞核的非典型性或其他的非典型性病变 |
| Ⅳ.滤泡性肿瘤 | 嗜酸细胞亚型的滤泡性肿瘤 |
| Ⅴ.可疑恶性肿瘤 | 可疑PTC |
| 可疑甲状腺髓样癌 | |
| 可疑转移癌 | |
| 可疑淋巴瘤 | |
| 其他 | |
| Ⅵ.恶性肿瘤 | PTC |
| 高级别滤泡性甲状腺癌 | |
| 甲状腺髓样癌 | |
| 未分化(间变性)癌 | |
| 鳞状细胞癌 | |
| 混合性癌(注明成分) | |
| 转移性恶性肿瘤 | |
| 非霍奇金淋巴瘤 | |
| 其他 |
表2 2023年TBSRTC恶性风险评估及临床处理意见推荐Table 2 Malignant risk assessment and recommendations for clinical management of TBSRTC of 2023 |
| 诊断分类 | 恶性风险均数(范围)/% | 临床管理 |
|---|---|---|
| Ⅰ.标本不能诊断 | 13(5~20) | 超声引导下重复FNAB |
| Ⅱ.良性 | 4(2~7) | 临床超声随访 |
| Ⅲ.意义不明确 | 22(13~30) | 重复FNAB、分子检测、诊断性腺叶切除或监测 |
| Ⅳ.滤泡性肿瘤 | 30(23~34) | 分子检测,诊断性甲状腺腺叶切除 |
| Ⅴ.可疑恶性肿瘤 | 74(67~83) | 分子检测,甲状腺腺叶或甲状腺近全叶切除 |
| Ⅵ.恶性肿瘤 | 97(97~100) | 甲状腺叶或甲状腺近全叶切除 |
3 初诊甲状腺乳头状癌手术治疗
3.1 手术适应证及手术方式选择
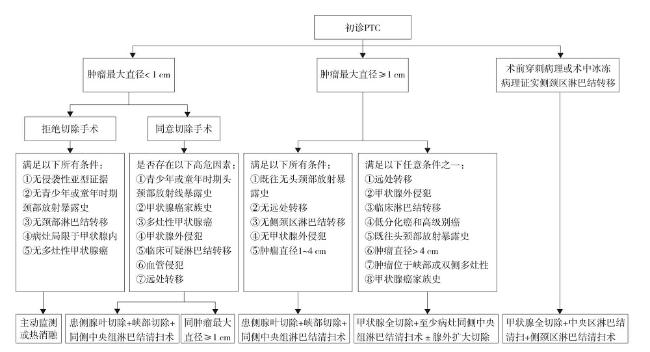
图3 甲状腺乳头状癌治疗流程注:上述甲状腺手术术式包括开放手术和腔镜手术,其中腔镜手术适应证:①肿瘤最大直径≤3 cm;②术前超声或CT提示颈侧区淋巴肿大,经细针穿刺病理学检查或术中冰冻病理学检查确诊淋巴结转移;③颈侧区淋巴结直径≤3 cm,无融合固定。腔镜手术禁忌证:①甲状腺癌病灶最大直径> 3 cm,有侵犯气管、食管、血管及喉返神经的临床表现;②颈侧区淋巴结最大直径> 3 cm,术前影像学检查评估颈侧区淋巴结周围组织有侵犯,查体淋巴结固定;③既往有颈侧区手术史或放射治疗史;④伴有其他器官或系统合并症不能耐受手术或全身麻醉;⑤髓样癌、未分化癌。 Figure 3 Procedure of treatment for papillary thyroid carcinoma |
3.2 手术方式和手术范围
3.2.1 开放手术
3.2.2 腔镜手术
3.2.3 热消融治疗
3.3 术中辅助技术
3.4 手术并发症及其处理措施
3.4.1 术后出血
3.4.2 术后甲状旁腺功能减退
3.4.3 术后喉返神经损伤
3.4.4 术后乳糜漏
3.4.5 伤口感染
3.4.6 热消融治疗后可能出现的特殊并发症
3.5 术后病理学检查内容
4 131I治疗
4.1 甲状腺乳头状癌术后分期及初始复发风险分层
4.1.1 术后分期
表3 甲状腺乳头状癌术后TNM分期Table 3 The PTC postoperative TNM staging |
| 基础 指标 | 定义 | 分期 | 不同年龄的分期标准 | |
|---|---|---|---|---|
| < 55岁 | ≥ 55岁 | |||
| Tx | 原发肿瘤无法评估 | |||
| T0 | 无原发肿瘤证据 | |||
| T1 | 肿瘤最大直径≤ 2 cm,局限于甲状腺内 | Ⅰ期 | 任何T,任何N,M0 | T1,N0/x,M0;T2,N0/x,M0 |
| T1a | 肿瘤最大直径≤ 1 cm,局限于甲状腺内 | |||
| T1b | 肿瘤最大直径> 1 cm但≤ 2 cm,局限于甲状腺内 | |||
| T2 | 肿瘤最大直径> 2 cm但≤ 4 cm,局限于甲状腺内 | |||
| T3 | 肿瘤最大直径> 4 cm且局限于甲状腺内,或肉眼可见 甲状腺外侵犯仅累及带状肌 | Ⅱ期 | 任何T,任何N,M1 | T1,N1,M0;T2,N1,M0; T3,N0,M0;T3,N1,M0 |
| T3a | 肿瘤最大直径> 4 cm且局限于甲状腺内 | |||
| T3b | 任何大小肿瘤,伴肉眼可见甲状腺外侵犯仅累及带状 肌(包括胸骨舌骨肌、胸骨甲状肌、甲状舌骨肌、 肩胛舌骨肌) | |||
| T4 | 肉眼可见甲状腺外侵犯超出带状肌 | |||
| T4a | 任何大小的肿瘤,伴肉眼可见甲状腺外侵犯累及皮下 软组织、喉、气管、食管或喉返神经 | Ⅲ期 | 无 | T4a,N0,M0; T4a,N1,M0 |
| T4b | 任何大小的肿瘤,伴肉眼可见甲状腺外侵犯累及椎前 筋膜,或包绕颈动脉或纵隔血管 | ⅣA期 | 无 | T4b,N0,M0; T4b,N1,M0 |
| N0 | 区域淋巴结无法评估 | |||
| N0a | 1个或更多细胞学或组织学确诊的良性淋巴结 | |||
| N0b | 无区域淋巴结转移的放射学或临床证据 | |||
| N1 | 区域淋巴结转移 | ⅣB期 | 无 | 任何T,任何N,M1 |
| N1a | Ⅵ和Ⅶ区淋巴结转移(气管前、气管旁、喉前/Deiph 淋巴结、上纵隔淋巴结),可为单侧或双侧病变 | |||
| N1b | 转移至单侧、双侧,或对侧颈侧淋巴结(Ⅰ、Ⅱ、Ⅲ、 Ⅳ、Ⅴ区)或咽后淋巴结 | |||
| M0 | 无远处转移 | |||
| M1 | 远处转移 | |||
4.1.2 初始复发风险分层
表4 甲状腺乳头状癌术后初始复发风险分层评估Table 4 The PTC postoperative evaluation of initial recurrence risk |
| 复发风险分层 | 定义 |
|---|---|
| 低危 | 需满足以下所有要点: |
| 无局部或远处转移 | |
| 所有肉眼可见的肿瘤均被完全切除或热消融 | |
| 无肿瘤侵犯甲状腺外组织 | |
| 原发灶为非侵袭性的病理亚型(侵袭性病理亚 型包括高细胞型、鞋钉型、柱状细胞型、高 级别PTCa等) | |
| 未发生血管侵犯 | |
| cN0或者虽发生pN1但转移淋巴结数不超过5 枚且淋巴结转移灶直径均小于2 mm | |
| 如果进行131I显像检查,显像无甲状腺以外碘 摄取灶 | |
| 中危 | 存在下述任一情况: |
| 原发灶向甲状腺外的镜下侵犯 | |
| 原发灶属于侵袭性病理亚型 | |
| 发生血管侵犯 | |
| cN1 | |
| pN1,淋巴结转移灶最大直径为0.2~3.0 cm或 转移灶超过5枚 | |
| 首次131I治疗后显像提示颈部摄碘灶 | |
| 高危 | 存在下述任一情况: |
| 高级别PTCa | |
| 原发灶向甲状腺外的肉眼侵犯 | |
| 原发灶和局部转移病灶未能被完全切除 | |
| 肿瘤发生远处转移 | |
| 甲状腺全切术后仍存在高水平血清Tg,提示未 排除远处转移 | |
| pN1,其中任何一个颈部淋巴结转移灶直径≥ 3 cm |
注: PTC指甲状腺乳头状癌;cN指临床N分期; pN指病理N分期;Tg指甲状腺球蛋白;a高级别PTC为不具有间变性特征、至少满足2个特征之一(有丝分裂指数≥5/2 mm2、肿瘤坏死)的PTC。 |
4.2 术后131I治疗
4.2.1 131I治疗的适应证
4.2.2 131I治疗的禁忌证
4.2.3 131I治疗前的准备事项
4.2.4 131I治疗的3个层次及推荐剂量
4.2.5 131I治疗的临床意义
4.3 131I治疗的不良反应及处理
4.3.1 放射性甲状腺炎
4.3.2 胃肠道不良反应
4.3.3 唾液腺损伤
4.3.4 血液系统不良反应
4.3.5 放射性肺炎和肺纤维化
4.4 治疗后随访及疗效评估
5 甲状腺乳头状癌术后动态评估和促甲状腺激素抑制治疗
5.1 PTC治疗后动态评估
表5 甲状腺乳头状癌术后动态评估Table 5 Postoperative dynamic evaluation of PTC patients |
| 疗效 | 手术方式 | 随访周期 | ||
|---|---|---|---|---|
| 甲状腺全切+131I治疗 | 甲状腺全切 | 腺叶切除或消融 | ||
| 疗效满意 | 影像阴性+TgAb检测阴性+抑制性Tg< 0.2 ng/mL+刺激性Tg<1 ng/mL | 影像阴性+TgAb检测阴性+抑制性Tg<0.2 ng/mL+刺激性Tg< 2 ng/mL | 影像阴性+TgAb检测阴性+抑制性Tg<30 ng/mL,稳 定 | 6~12个月 |
| 疗效不确切 | 影像非特异发现或DxWBS提示甲状腺有微量核素摄取+TgAb稳定或逐渐下降+抑制性Tg 0.2~1.0 ng/mL+刺激性Tg 1~10 ng/mL | 影像非特异发现或DxWBS提示甲状腺有微量核素摄取+TgAb稳定或逐渐下降+抑制性Tg 0.2~ 5.0 ng/mL+刺激性Tg 2~10 ng/mL | 影像非特异发现+TgAb稳定或逐渐下降 | 3~6个月 |
| 生化疗效不佳 | 影像阴性+TgAb逐渐升高+抑制性Tg≥1.0 ng/mL+刺激性Tg≥10 ng/mL | 影像阴性+TgAb逐渐升高+抑制性Tg>5 ng/mL或TSH类似水平下逐渐增高+刺激性Tg>10 ng/mL或TSH类似水平下逐渐升高 | 影像阴性+抑制性Tg> 30 ng/mL或TSH类似水平下逐渐升高 | 3~6个月 |
| 结构性疗效不佳 | 结构性或功能性病灶 | 结构性或功能性病灶 | 结构性或功能性病灶 | 3~6个月 |
注:TgAb为甲状腺球蛋白抗体;Tg为甲状腺球蛋白;DxWBS为诊断性131I全身显像。 |
5.2 促甲状腺激素抑制治疗
5.2.1 促甲状腺激素抑制的定义和指征
5.2.2 促甲状腺激素抑制目标
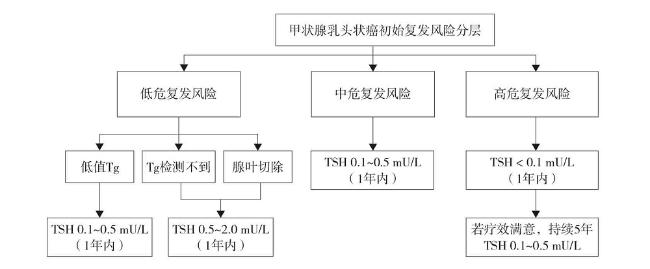
图4 甲状腺乳头状癌初治期(1年内)促甲状腺激素抑制目标注:TSH为促甲状腺激素;Tg为甲状腺球蛋白。 Figure 4 TSH suppression targets in the initial treatment stage (within 1 year) of papillary thyroid carcinoma |
表6 甲状腺乳头状癌手术1年后促甲状腺激素抑制目标(5年内高危复发风险患者除外) 单位:mU/LTable 6 TSH suppression targets after PTC surgery for 1 year (excluding high-risk recurrence risk patients within 5 years) |
| TSH抑制治疗 不良反应风险 | 动态疗效评估 | |||
|---|---|---|---|---|
| 疗效满意 | 疗效不确切 | 生化疗效不佳 | 结构性疗效不佳 | |
| 无风险或未知风险 | 0.5~2.0 | 0.1~0.5 | <0.1 | <0.1 |
| 低风险 | 0.5~2.0 | 0.1~0.5 | 0.1~0.5 | <0.1 |
| 中风险 | 0.5~2.0 | 0.5~2.0 | 0.1~0.5 | <0.1 |
| 高风险 | 0.5~2.0 | 0.1~2.0 | 0.5~2.0 | 0.1~0.5 |
注:TSH为促甲状腺激素。低风险指绝经、心动过速、骨量减少;中风险指年龄> 60岁、骨质疏松;高风险指心房颤动。 |