1 资料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准
1.1.2 排除标准
1.2 文献检索
1.3 文献筛选与资料提取
1.4 质量评价
1.5 统计学方法
2 结果
2.1 文献筛选流程及结果
2.2 纳入文献的基本特征
表1 纳入文献的基本特征Table 1 Basic characteristics of the included studies |
| 作 者 | 国家 | n(硫酸镁组/对照组) | 手术类型 | 麻醉方式 | 干预措施 | 结局指标(睡眠质量) | ||
|---|---|---|---|---|---|---|---|---|
| 硫酸镁组 | 对照组 | |||||||
| 负荷量 | 维持量 | |||||||
| BHATIA等[25] | 印度 | 25/25 | 胆囊切除术 | 全身麻醉 | 50%硫酸镁 50 mg/kg | 15 mg/(kg·h) | 生理盐水 | VAS评分 |
| KAYALHA等[26] | 伊朗 | 30/30 | 下肢骨折手术 | 椎管内麻醉 | — | 5 mg/kg | 生理盐水 | VAS评分 |
| LEVAUX等[27] | 比利时 | 12/12 | 腰椎矫形手术 | 全身麻醉 | — | 50 mg/kg | 生理盐水 | VAS评分 |
| SAADAWY等[28] | 埃及 | 40/40 | 胆囊切除术 | 全身麻醉 | 50 mg/kg | 25 mg/(kg·h) | 生理盐水 | VAS评分 |
| TRAMER等[29] | 瑞士 | 21/21 | 子宫切除术 | 全身麻醉 | 20%硫酸镁 15 mL | 2.5 mL/h | 生理盐水 | VAS评分 |
2.3 质量评价结果
2.4 荟萃分析结果
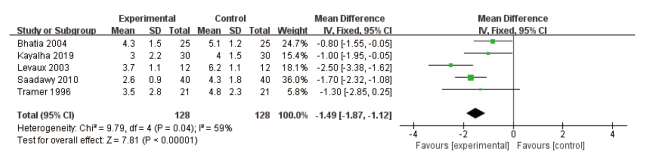
2.4.1 术后第1晚睡眠质量VAS评分
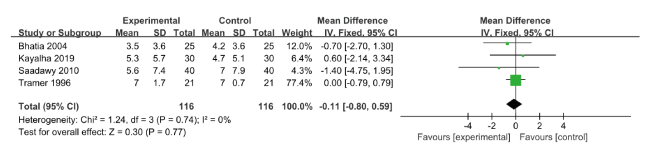
2.4.2 术后运动状态下疼痛VAS评分
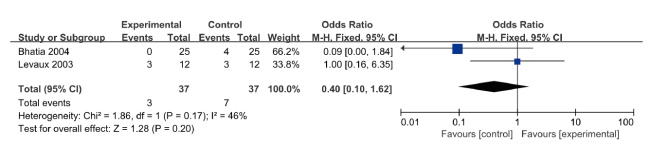
图4 硫酸镁组与安慰剂组对术后6 h运动状态下疼痛VAS评分影响的meta分析森林图Figure 4 Forest plot of meta-analysis for the effect of magnesium sulfate vs. placebo on pain VAS scores in the 6-hour postoperative motor state |
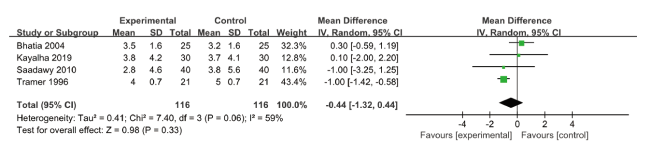
2.4.3 安全性结局
表2 硫酸镁相关不良事件Table 2 Adverse events associated with magnesium sulfate |
| 不良事件 | 纳入研究 | 硫酸镁组(n) | 对照组(n) |
|---|---|---|---|
| 恶心呕吐 | Bhatia(2004) | 3 | 4 |
| Levaux(2003) | 0 | 1 | |
| Saadaw(2010) | 16 | 17 | |
| 寒战 | Bhatia(2004) | 0 | 4 |
| Levaux(2003) | 3 | 3 | |
| 低血压 | Levaux(2003) | 8 | 6 |
| Tramer(1996) | 1 | 0 | |
| 心动过缓 | Tramer(1996) | 1 | 2 |
| 镇静 | Saadaw(2010) | 3 | 0 |
| 术后24 h无排气 | Saadaw(2010) | 3 | 4 |
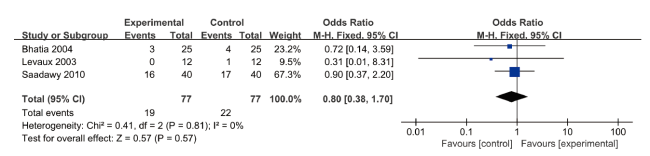
图6 硫酸镁对比安慰剂恶心呕吐发生率的meta分析森林图Figure 6 Forest plot of meta-analysis comparing the incidence of nausea and vomiting between magnesium sulfate and placebo |
图7 硫酸镁对比安慰剂寒战发生率的meta分析森林图Figure 7 Forest plot of meta-analysis comparing the incidence of shivering between magnesium sulfate and placebo |