1 材料与方法
1.1 实验材料
1.1.1 实验动物
1.1.2 饲料
表1 3种饲料宏量营养素供能比Table 1 Macronutrient energy supply ratio of 3 kinds of feed |
| 饮 食 | 碳水化合物 | 脂肪 | 蛋白质 |
|---|---|---|---|
| 基础饲料 | 61.65% | 23.95% | 14.49% |
| 5%高蛋白低碳饲料 | 5.01% | 66.00% | 28.99% |
| 30%高蛋白低碳饲料 | 30.01% | 41.00% | 28.99% |
1.1.3 实验仪器设备
1.1.4 实验试剂
1.2 实验方法
1.2.1 饮食干预与动物处理
1.2.2 血脂检测
1.2.3 肠道内容物收集
1.2.4 SCFAs检测
1.3 统计学方法
2 结果
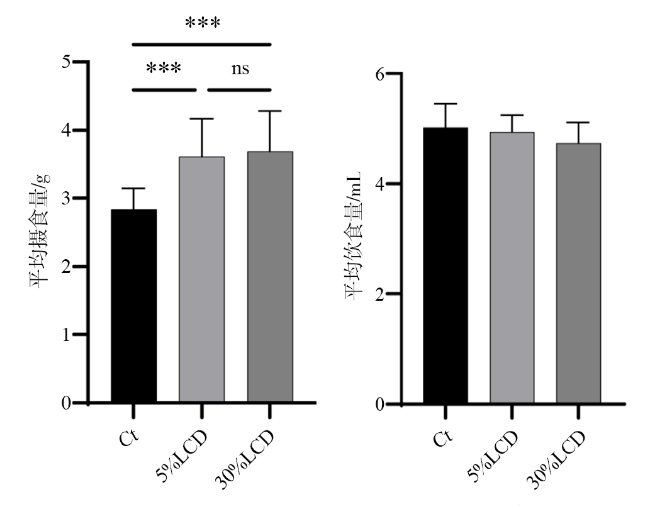
2.1 不同高蛋白低碳水化合物饮食对小鼠摄食量和饮水量的影响
2.2 不同高蛋白低碳水化合物饮食对小鼠体重的影响
表2 3组不同饮食小鼠体重变化Table 2 Body weight changes in three groups of mice with different diets |
| 时 间 | Ct组(n=8) | 5%LCD组(n=8) | 30%LCD组(n=8) |
|---|---|---|---|
| 第0天/g | 18.01±0.52 | 17.96±1.53 | 18.04±0.31 |
| 第7天/g | 20.36±0.54a | 21.33±0.37a | 21.03±0.39a |
| 第14天/g | 21.94±0.26a | 22.25±0.41a | 22.25(1.20)a |
| 第21天/g | 23.34±0.32a | 23.44±0.37a | 23.60(1.15)a |
| 第28天/g | 24.26±0.34a | 24.34±0.44a | 24.98±0.48a |
注:与第0天比较,aP < 0.001。 |
2.3 不同高蛋白低碳水化合物饮食对小鼠血脂的影响
表3 3组不同饮食小鼠血清中TC、TG、LDL-C、HDL-C水平比较Table 3 Comparison of serum TC, TG, LDL-C, and HDL-C levels among three groups of mice with different diets |
| 组 别 | n | TC/(mmol/L) | TG/(mmol/L) | LDL-C/(mmol/L) | HDL-C/(mmol/L) |
|---|---|---|---|---|---|
| Ct组 | 8 | 2.97(0.45) | 1.09±0.20 | 3.04±0.34 | 1.12±0.25 |
| 5%LCD组 | 8 | 3.53(0.67)a | 1.01±0.17 | 4.30±0.69a | 1.61±0.52 |
| 30%LCD组 | 8 | 3.32(0.24) | 1.17±0.35 | 3.79±0.45a | 1.85±0.46a |
| H/F值 | 7.600 | 0.600 | 7.958 | 3.882 | |
| P值 | 0.020 | 0.560 | 0.005 | 0.046 |
注:与Ct组比较,aP < 0.05。 |
2.4 不同高蛋白低碳水化合物饮食对小鼠盲肠SCFAs含量影响的研究
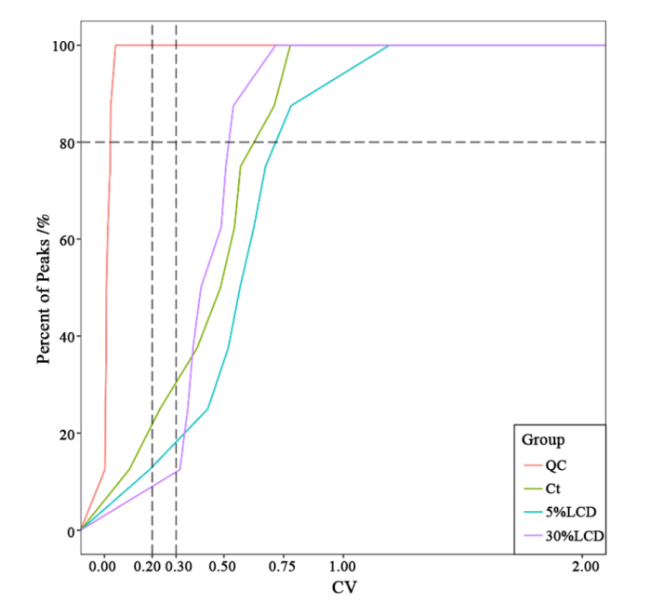
2.4.1 样本标准曲线和质控分析
表4 SCFAs检测的标准曲线线性方程及决定系数Table 4 Linear equation and determination coefficient of standard curve detected by SCFAs |
| SCFAs | 保留时间/min | 标准曲线 | R2 | 线性范围/(mg/L) |
|---|---|---|---|---|
| 丙酸 | 7.878 | y = 0.969 861 x + 0.093 002 | 0.997 9 | 0.02~20.00 |
| 异丁酸 | 8.070 | y = 0.387 122 x + 0.003 337 | 0.999 5 | 0.02~20.00 |
| 戊酸 | 9.232 | y = 8.510 691 x + 0.080 643 | 0.999 5 | 0.05~20.00 |
| 异戊酸 | 8.776 | y = 7.704 121 x + 0.071 347 | 0.999 6 | 0.02~20.00 |
| 己酸 | 9.909 | y = 7.810 785 x | 0.998 8 | 0.02~20.00 |
| 丁酸 | 8.502 | y = 1.529 582 x + 0.032 124 | 0.999 6 | 0.02~20.00 |
| 乙酸 | 7.251 | y = 1.258 682 x + 0.446 052 | 0.998 6 | 0.02~20.00 |
注:纵坐标表示小于对应CV值的物质数目占总物质数的比例,QC为质控样本。 |
2.4.2 不同高蛋白低碳水化合物饮食对小鼠SCFAs含量的影响
表5 各组小鼠SCFAs相对含量比较Table 5 Comparison of SCFAs contents in mice of each group |
| 项 目 | Ct组(n=4) | 5%LCD组(n=4) | 30%LCD组(n=4) | H/F值 | P值 |
|---|---|---|---|---|---|
| 丙酸/(μg/g) | 444.31±103.47 | 185.35±125.09a | 171.5±83.94a | 8.484 | 0.008 |
| 异丁酸/(μg/g) | 58.23±28.31 | 18.29±14.30a | 21.93±11.85a | 5.103 | 0.033 |
| 戊酸/(μg/g) | 40.88±29.08 | 19.13±9.92 | 22.16±7.01 | 1.676 | 0.241 |
| 异戊酸/(μg/g) | 39.73±21.66 | 13.48±8.44a | 13.32±5.39a | 4.873 | 0.037 |
| 己酸/(μg/g) | 3.24±0.34 | 2.83±0.54 | 3.39±1.18 | 0.559 | 0.590 |
| 丁酸/(μg/g) | 303.32±172.98 | 99.18±42.95a | 180.44±91.78 | 3.153 | 0.092 |
| 乙酸/(μg/g) | 1 158.54(883.27) | 921.23(628.47) | 696.35(500.59) | 2.346 | 0.309 |
| 总SCFAs/(μg/g) | 2 079.93±795.53 | 1 061.92±587.64a | 1 167.67±456.54 | 3.168 | 0.091 |
注:与Ct组比较,aP < 0.05。 |