一、EV的分类、产生机制及特征
表1 3种EV亚群的主要特征 |
| 特 征 | 外泌体 | 微囊泡 | 凋亡小体 |
|---|---|---|---|
| 大小(nm) | 30 ~ 120 | 100 ~ 1000 | 800 ~ 5000 |
| 形态 | 杯状 | 多样 | 多样 |
| 起源 | 多囊泡体 | 细胞质膜 | 细胞质膜 |
| 形成机制 | 多囊泡体胞外分泌 | 细胞质膜出苞方式 | 细胞质膜出苞方式 |
| 通路 | ESCRT-依赖性 | Ca2+依赖性 | 凋亡相关通路 |
| 四跨膜蛋白依赖性 | 刺激和细胞依赖性(不同通路) | ||
| 释放时间 | 10 min或更久 | 几十分之一秒 | |
| 富含蛋白标志物 | CD81、CD63、Alix、 Tsg101 | 选择素、整合素、CD40 | Caspase 3、组蛋白 |
| 组成 | 蛋白质、脂质、编码RNA、非 编码RNA、DNA | 蛋白质、脂质、细胞器、编码RNA、非编码RNA、DNA | 细胞器、蛋白质、核酸片段、编码RNA、非编码RNA,DNA |
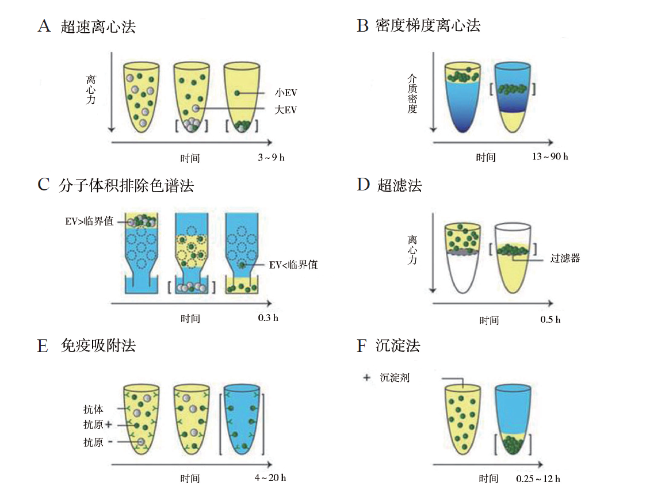
二、分离方法
表2 分离EV常用方法比较 |
| 分离方法 | 工作原理 | 优点 | 缺点 |
|---|---|---|---|
| 超速离心法 | 分离基于EV的大小,大的(灰色)较早沉淀在管底,而小的(绿色)需更大的离心力才能沉淀。可溶性组分不受离心影响,但是非EV颗粒如脂蛋白和蛋白质聚集体可能会一同沉淀 | 分离外泌体纯度较高,是目前分离外泌体的金标准,最为常用 | 仪器昂贵,技术难度高,耗时费力,产量低,重复离心操作可能对EV造成破坏,影响质量 |
| 密度梯度离心法 | 分离基于EV的密度,可从不同密度的颗粒分离出EV,EV将移动至其平衡密度,而高密度的可溶性组分将在管底沉淀 | 可从其他囊泡、颗粒和污染物中分离低密度EV,获得的EV纯度较高 | 步骤繁琐,耗时,对离心时间极为敏感 |
| 分子体积排除色谱法 | 基于EV分子的大小用多孔凝胶基质(虚线圆圈)进行分离。可溶性组分和粒径小于临界值的颗粒进入多孔基质,而大于临界值的EV和颗粒不进入多孔基质,快速洗脱出。此法可精确分离大、小分子 | 此法分离的EV纯度较高,在电镜下大小均一,不受可能改变囊泡结构的剪切力影响 | 需要特殊的设备,耗时费力,获取量少,应用不广泛 |
| 超滤法 | EV大于一般的蛋白质,利用不同截留相对分子质量的超滤膜对样品进行选择性分离,可溶性蛋白质和小于临界值(约105 kDa)的颗粒被推向过滤膜,然后在过滤膜处收集EV | 简单高效,可将EV与小颗粒和可溶性分子分离,且不影响其生物活性 | EV可能附着在过滤膜上流失,超滤过膜时加压可引起EV变形或破坏,可能受蛋白污染 |
| 免疫吸附法 | 基于EV表面特异性标记物,用包被相应抗体的磁珠与EV共同孵育后,即可将EV吸附并分离出来。图示中使用针对暴露在目标(绿色)EV上抗原的单克隆抗体捕获EV | 操作简单,特异性高,不影响EV形态完整,纯度尚可,得到的EV直接用于分析或用于DNA或总RNA分离 | 效率低,外泌体生物活性易受pH和盐浓度影响,不利于下游实验,抗体价格昂贵且不可回收,不适合从大量样本获得EV |
| 沉淀法 | 基于聚合物的沉淀剂与疏水性蛋白和脂质分子结合共沉淀来分离EV,非EV颗粒和可溶性蛋白质也可被聚集沉淀。最常见的聚合物之一是聚乙二醇 | 操作简便,技术难度低,耗时短 | 纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20℃等化学添加物将会破坏外泌体 |