同时,既往研究报道,全基因组关联性研究证实了与IBD相关的多个基因位点的单核苷酸多态性如ATG16L、NOD2、LRRK2、IRGM等分别调控IBD中的自噬发生
[3⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓, 16]。研究表明,具有ATG16L1的单核苷酸多态性的人类细胞自噬受损,对病原体的清除能力减弱,潘氏细胞和杯状细胞功能紊乱
[17]。目前已有大量的研究报道自噬在肠道固有免疫和适应性免疫中发挥着重要的作用。在固有免疫中,自噬与模式识别受体相互作用,如Toll样受体、NOD样受体等,识别并消除侵入细胞的病原体。同时在肠道中,内源性和外源性微生物可通过自噬进行抗原呈递,并对共生物抗原耐受性的产生具有重要作用
[18]。许多自噬相关蛋白(如Beclin1、Atg3、Atg5和Atg7)对T淋巴细胞的生存、发育和成熟是必要的
[19-20]。干扰自噬导致肠道内固有免疫和适应性免疫受损,自噬缺陷可影响细胞抗原肽的呈递、损害细胞内细菌清除能力等
[16⇓-18]。然而,自噬是把双刃剑,在炎症中具有双向调节作用,适当的自噬可以降解受损或衰老的细胞器以及错误折叠的蛋白质,而过度的自噬会引起细胞自噬性死亡。有研究报道,过度的自噬会损害上皮细胞的紧密连接,抑制过度的自噬,从而恢复ZO-1和E-cadherin的表达
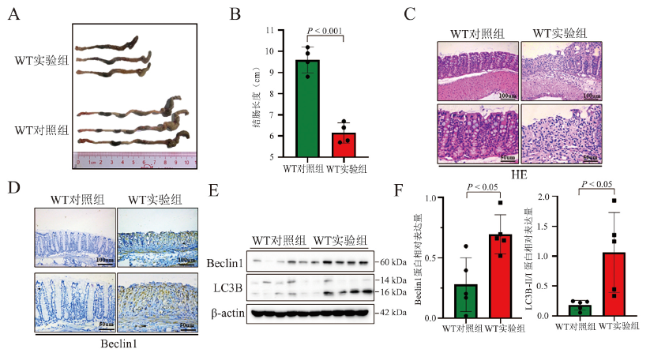
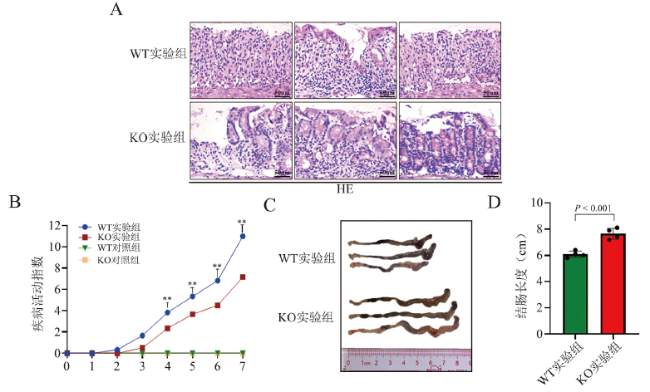
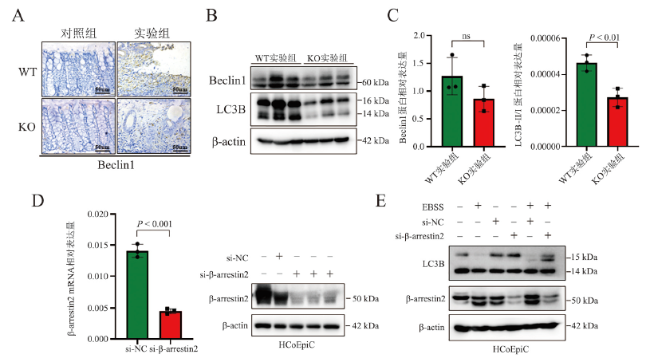
[21]。为此,我们在实验中先探究了小鼠急性UC模型中自噬水平的变化,通过蛋白免疫印迹、免疫组织化学等检测方法,发现诱导小鼠急性UC后,自噬相关蛋白的表达水平上调。而β-arrestin2的缺失可以改善小鼠结肠黏膜的炎症,于是我们进一步探究β-arrestin2是否可以通过调控自噬来调节肠道的炎症。因此我们分析了β-arrestin2 WT小鼠和β-arrestin2 KO小鼠在急性UC模型中自噬水平的变化,结果发现β-arrestin2的缺失可以抑制自噬的发生,进一步在人源性的结肠上皮细胞HCoEpic中进行验证。通过饥饿诱导细胞自噬的发生,发现沉默β-arrestin2表达的细胞中,自噬相关蛋白表达水平下降,自噬水平受到抑制。