对象与方法
一、研究对象
二、纳入、排除、剔除标准
三、研究过程
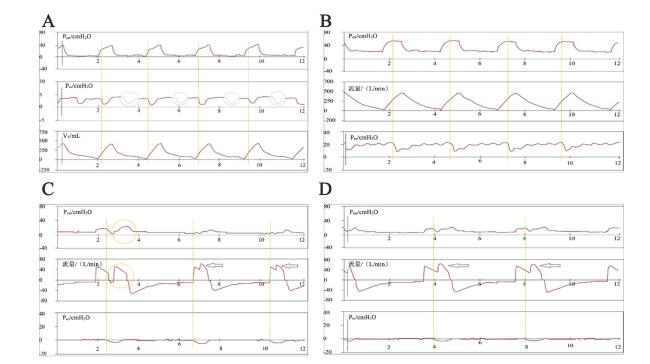
图1 4种不同RT表型的呼吸波形示例注:如果在呼吸机送气开始后出现了患者的自主呼吸努力,就将其定义为具有RT的呼吸。该图展示了4种RT表型,绿色线条表示Pes负向偏转的开始,即患者自发的吸气努力。A图为早期RT:Pes负向偏转发生在呼吸机送气期间,并伴随无效触发(在蓝色圆圈标记出的Pes负向偏转后,并没有呼吸机送气)。B图为中期RT:患者的自主吸气努力在送气期开始,且最大收缩点发生在呼气期。C图包含两种表型,第1次呼吸为晚期RT伴呼吸堆叠,即Pes负向偏转及整个RT过程均发生在呼气期,且患者的吸气努力足以触发另一次辅助机械呼吸(黄圈),导致双重触发。第2、3次呼吸,Pes负向偏转发生在呼吸机送气期间,并且呼吸机触发的呼吸努力持续到了呼气期,同时由于吸气努力的存在导致流量的二次增加(箭头),也属于中期RT范畴。D图为晚期RT:患者的自主吸气努力出现在呼气期,且吸气努力也使流量二次叠加(箭头)。 |
四、统计学处理
结果
一、研究对象一般资料
表1 浅镇静组与中度镇静组的一般资料比较 |
| 变 量 | 浅镇静组(28例) | 中度镇静组(35例) | t/χ 2/Z值 | P值 |
|---|---|---|---|---|
| 年龄/岁 | 68.2±4.5 | 69.1±6.4 | -0.652 | 0.517 |
| 男性/例(%) | 18(64) | 21(60) | 0.121 | 0.728 |
| 病因/例(%) | 0.319 | 0.989 | ||
| 肺部感染 | 10(36) | 13(37) | ||
| COPD急性加重 | 5(18) | 6(17) | ||
| 多发伤 | 4(14) | 5(14) | ||
| 外科术后 | 6(21) | 6(17) | ||
| 心脑血管病变 | 3(11) | 5(14) | ||
| 呼吸机模式-VAC/例(%) | 22(79) | 32(91.4) | 2.100 | 0.147 |
| 呼吸机参数 | ||||
| VT/mL | 391.1±42.0 | 436.9±36.9 | -4.600 | 0.001 |
| PEEP/cmH2O | 8.0(6.0,10.0) | 8.0(5.0,12.0) | -0.078 | 0.938 |
| FiO2/% | 46.4±7.8 | 49.7±8.2 | -1.612 | 0.112 |
| 血气分析 | ||||
| pH | 7.5(7.4,7.5) | 7.4(7.3,7.5) | -4.173 | <0.001 |
| PaCO2/mmHg | 48.0(25.2,69.2) | 44.2(40,63.1) | -0.570 | 0.568 |
| PaO2/mmHg | 74.8±7.1 | 67.1±25.8 | 1.678 | 0.101 |
| 机械通气时间/d | 7.9±1.9 | 8.6±2.4 | -1.275 | 0.207 |
| ICU住院时间/d | 9.9±2.3 | 9.9±2.9 | -0.032 | 0.974 |
| APACHEⅡ评分/分 | 17.0(14.0,28.0) | 25.0(18.0,31.0) | -2.843 | 0.005 |
注:VAC为容量辅助/控制通气;FiO2为吸入氧浓度;1 cmH2O=0.098 kPa;1 mmHg=0.133 kPa。 |
二、RT发生的风险因素分析
表2 RT发生的风险因素分析 |
| 变 量 | B值 | B值标准误 | Wald χ 2值 | P值 | OR值 | OR值的95%CI |
|---|---|---|---|---|---|---|
| APACHEⅡ评分 | 0.83 | 0.56 | 2.20 | 0.138 | 2.28 | 0.77~6.80 |
| RASS评分 | 1.11 | 0.54 | 4.20 | 0.040 | 3.03 | 1.05~8.77 |
| VT | -0.94 | 0.97 | 0.94 | 0.332 | 0.39 | 0.06~2.61 |
| PEEP | -0.40 | 0.41 | 0.97 | 0.324 | 0.67 | 0.30~1.49 |
| FiO2 | -1.06 | 0.69 | 2.38 | 0.123 | 0.35 | 0.09~1.33 |
| pH | 0.71 | 0.38 | 3.44 | 0.064 | 2.02 | 0.96~4.27 |
| PaO2 | 0.06 | 0.29 | 0.05 | 0.826 | 1.07 | 0.60~1.89 |
| PaCO2 | 0.53 | 0.41 | 1.69 | 0.193 | 1.70 | 0.77~3.76 |
注:因变量为RT的发生与否,各变量按照数值由低至高分别赋值,其中APACHE Ⅱ评分以10分、RASS评分以-1分、VT以50 mL、PEEP以1 cmH2O、FiO2以10%、pH以0.1、PaO2以20 mmHg、PaCO2以10 mmHg分别为1单位。 |
三、镇静深度对RT发生率的影响
表3 镇静加深前后RT发生率的比较 单位:例 |
| 组 别 | 镇静加深前 | 镇静加深后 | |
|---|---|---|---|
| 发生RT | 未发生RT | ||
| 浅镇静组(28例) | 发生RT | 5 | 1 |
| 未发生RT | 10 | 12 | |
| 中度镇静组(35例) | 发生RT | 7 | 3 |
| 未发生RT | 12 | 13 | |
四、RT与机械通气时间及ICU住院时间相关性分析
表4 是否发生RT对机械通气时间与ICU住院时间的影响 单位:d |
| 项 目 | 发生RT (16例) | 未发生RT (47例) | t值 | P值 |
|---|---|---|---|---|
| 机械通气时间 | 7.1±1.8 | 8.6±2.2 | 2.446 | 0.017 |
| ICU住院时间 | 8.9±2.7 | 10.2±2.5 | 1.746 | 0.086 |