对象与方法
一、研究对象
二、研究方法
1. 样品采集
2. 肠道菌群的检测
3. 数据分析
三、统计学处理
结 果
一、健康对照组、未透析组、PD组、HD组的临床资料比较
表1 健康对照组、未透析组、PD组、HD组的临床资料比较 |
| 项 目 | 健康对照组(19例) | 未透析组(38例) | PD组(25例) | HD组(27例) | $\chi$2/t/Z/ F/H值 | P值 |
|---|---|---|---|---|---|---|
| 男性[例(%)] | 9(47) | 18(47) | 16(64) | 15(56) | 2.010 | 0.581 |
| 年龄(岁) | 46.5±6.7 | 49.0±13.0 | 55.0±10.5 | 52.9±14.5 | 7.639 | 0.054 |
| BMI(kg/m2) | 23.1±1.1 | 22.6±3.1 | 23.6±3.5 | 21.8±3.0 | 7.401 | 0.060 |
| 糖尿病[例(%)] | - | 13(34) | 9(36) | 10(37) | 0.058 | 1.000 |
| 高血压病[例(%)] | - | 33(87) | 25(100) | 24(93) | 3.459 | 0.225 |
| 总胆固醇(mmol/L) | 4.57±0.46 | 4.26±1.09 | 4.37±0.93 | 3.85±0.94 | 1.605 | 0.194 |
| 甘油三酯(mmol/L) | 1.41(0.90,1.99) | 1.17(0.91,1.69) | 0.87(0.67,1.83) | 1.20(0.79,1.68) | 1.773 | 0.621 |
| HDL-C(mmol/L) | 1.08±0.15 | 1.11±0.33 | 1.01±0.28 | 1.04±0.27 | 0.530 | 0.663 |
| LDL-C(mmol/L) | 2.92±0.82 | 2.58±0.92 | 2.68±0.85 | 2.26±0.76 | 1.546 | 0.208 |
| 血清铁(μmol/L) | 12.4(5.6,19.2) | 11.2(6.1,16.3) | 9.8(5.8,13.9) | 9.3(7.4,11.6) | 0.539 | |
| 血红蛋白(g/L) | 132±21 | 84±20 | 95±17 | 105±18 | 20.707 | < 0.001 |
| 血清白蛋白(g/L) | 44±4 | 36±4 | 32±3 | 40±3 | 24.912 | < 0.001 |
| 透析时间(年) | - | - | 3.0(1.5,3.3) | 3.0(2.0,6.0) | 1.106 | 0.269 |
| 透析充分性(Kt/V) | - | - | 1.8(1.6,2.1) | 1.6(1.5,1.9) | -1.906 | 0.057 |
| 血尿素氮(mmol/L) | 4.5±1.6 | 26.7±10.4 | 17.9±5.8 | 24.6±5.9 | 40.724 | < 0.001 |
| 血肌酐(μmol/L) | 70±19 | 865±341 | 1 001±236 | 1 085±270 | 34.182 | < 0.001 |
| 肾小球滤过率[ml/(min·1.73 m2)] | 101(90,113) | 6(3,8) | 4(4,5) | 4(3,4) | 28.225 | < 0.001 |
| 血钙(mmol/L) | 2.31±0.14 | 2.12±0.25 | 2.26±0.24 | 2.27±0.25 | 2.795 | 0.045 |
| 血磷(mmol/L) | 1.04±0.34 | 1.70±0.41 | 1.42±0.40 | 1.86±0.53 | 6.244 | 0.001 |
| 血钾(mmol/L) | 4.07±0.36 | 4.29±0.74 | 3.73±0.62 | 4.80±0.71 | 9.887 | < 0.001 |
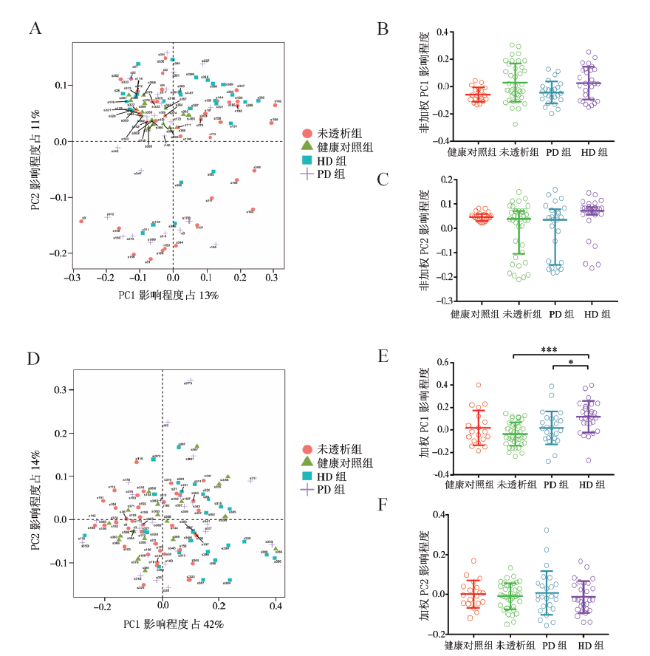
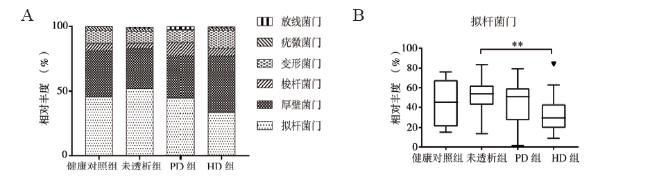
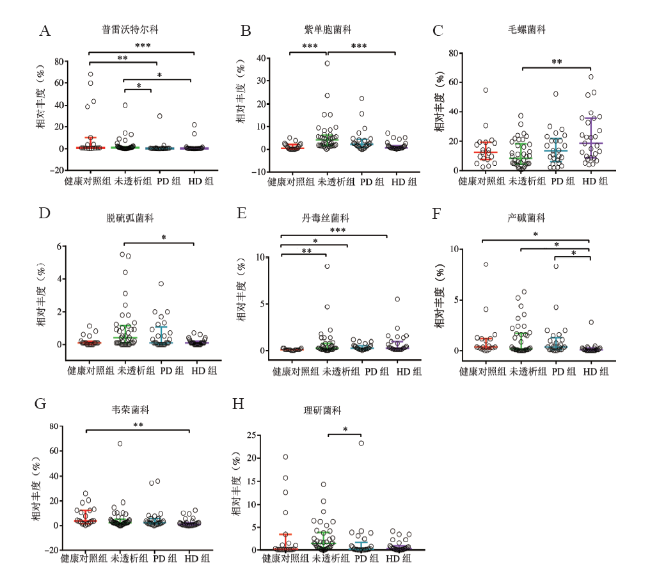
二、肠道菌群多样性的改变
表2 健康对照组、未透析组、PD组、HD组的Observed species 、Chao1、Simpson指数比较 |
| 指 数 | 健康对照组 | 未透析组 | PD组 | HD组 | F/H值 | P值 |
|---|---|---|---|---|---|---|
| Chao1 | 243±25 | 267±92 | 232±51 | 257±67 | 5.927 | 0.115 |
| Observed species | 168±18 | 200±74 | 166±41 | 189±55 | 6.670 | 0.083 |
| Simpson | 0.851(0.796,0.866) | 0.910(0.845,0.923) | 0.882(0.839,0.938) | 0.865(0.806,0.921) | -24.816 | 0.001 |
| 非加权PC1 | -0.058±0.053 | 0.031±0.141 | -0.043±0.082 | 0.027±0.120 | 9.456 | 0.024 |
| 非加权PC2 | 0.046(0.032,0.059) | 0.039(-0.105,0.071) | 0.036(-0.150,0.079) | 0.072(0.056,0.088) | 8.329 | 0.040 |
| 加权PC1 | 0.017±0.155 | -0.037±0.105 | 0.017±0.147 | 0.116±0.140 | 6.979 | <0.001 |
| 加权PC2 | 0.002±0.070 | -0.009±0.066 | 0.007±0.110 | -0.013±0.081 | 0.340 | 0.796 |