1 对象与方法
1.1 研究对象
表1 各中心名称及收集病例数Table 1 Names of participating centers and number of cases collected |
| 序 号 | 中心名称 | 收集病例数 |
|---|---|---|
| 1 | 中山大学附属第三医院 | 135 |
| 2 | 武汉市中心医院 | 24 |
| 3 | 陕西省人民医院 | 18 |
| 4 | 成都市第五人民医院 | 15 |
| 5 | 河南省人民医院 | 9 |
| 6 | 广西医科大学第一附属医院 | 7 |
| 7 | 南充市中心医院 | 7 |
| 8 | 包钢三医院(包头妇产医院) | 7 |
| 9 | 惠州市中心人民医院 | 5 |
| 10 | 山西省妇幼保健院 | 5 |
1.2 研究设计
1.3 仪器与方法
1.4 图像分析
1.5 诊断标准
1.6 统计学方法
2 结果
2.1 良性组与恶性组的一般资料比较
表2 良性组与恶性组的一般资料比较Table 2 Comparison of general information between benign and malignant groups |
| 临床资料 | 良性组(n=130) | 恶性组(n=94) | t/ χ 2/Z值 | P值 |
|---|---|---|---|---|
| 年龄/岁 | 39.4±14.1 | 48.1±13.8 | -4.588 | <0.001 |
| 月经状态/n(%) | ||||
| 绝经状态 | 27(20.8) | 50(53.2) | 25.308 | <0.001 |
| 未绝经状态 | 103(79.2) | 44(46.8) | ||
| 病灶位置/n(%) | ||||
| 单侧 | 128(98.5) | 88(93.6) | 0.071a | |
| 双侧 | 2(1.5) | 6(6.4) | ||
| CA125/(kU/L)b | 23.1(14.8,32.6) | 89.1(31.4,571.0) | -7.304 | <0.001 |
注:aFisher确切概率法;b糖类抗原125(carbohydrate antigen 125,CA125)。 |
2.2 病理类型分布及超声特征分析
表3 良性组与恶性组的超声特征比较Table 3 Comparison of ultrasound characteristics between benign and malignant groups |
| 项 目 | 分类 | 超声特征/n(%) | χ 2值 | P值 | |
|---|---|---|---|---|---|
| 良性组(n=132) | 恶性组(n=100) | ||||
| 病变类型 | 单房囊肿无实性成分 | 8(6.1) | 1(1.0) | 41.930 | <0.001 |
| 双房囊性无实性成分 | 6(4.5) | 0(0) | |||
| 多房囊肿无实性成分 | 23(17.4) | 3(3.0) | |||
| 单房囊肿伴实性成分 | 34(25.8) | 15(15.0) | |||
| 多房囊肿伴实性成分 | 49(37.1) | 46(46.0) | |||
| 实性或实性样病变(实性成分≥80%) | 12(9.1) | 35(35.0) | |||
| 病变最大直径 | <3 cm | 6(4.6) | 2(2.0) | 6.599 | 0.087 |
| 3~<5 cm | 21(15.9) | 11(11.0) | |||
| 5~<10 cm | 66(50.0) | 42(42.0) | |||
| ≥10 cm | 39(29.5) | 45(45.0) | |||
| 血流评分 | 1分 | 41(31.0) | 5(5.0) | 53.843 | <0.001 |
| 2分 | 67(50.8) | 34(34.0) | |||
| 3分 | 21(15.9) | 43(43.0) | |||
| 4分 | 3(2.3) | 18(18.0) | |||
| 是否伴腹水 | 是 | 6(4.5) | 23(23.0) | 17.716 | <0.001 |
| 否 | 126(95.5) | 77(77.0) | |||
表4 O-RADS分类结果与病理结果对照Table 4 Comparison between O-RADS and pathological results |
| 病理诊断 | O-RADS 4类 | O-RADS 5类 | 合计 |
|---|---|---|---|
| 良性 | 102 | 30 | 132 |
| 浆液性囊腺瘤 | 27 | 3 | |
| 子宫内膜样囊肿 | 25 | 3 | |
| 畸胎瘤 | 18 | 5 | |
| 黏液性囊腺瘤 | 13 | 3 | |
| 炎性病变 | 9 | 9 | |
| 生理性/单纯性囊肿 | 4 | 2 | |
| 纤维瘤 | 2 | 1 | |
| 其他性索间质肿瘤 | 4 | 4 | |
| 交界性 | 21 | 12 | 33 |
| 浆液性囊腺瘤 | 11 | 4 | |
| 黏液性囊腺瘤 | 6 | 6 | |
| 浆-黏液性囊腺瘤 | 3 | 1 | |
| 子宫内膜样肿瘤 | 1 | 1 | |
| 恶性 | 13 | 54 | 67 |
| 浆液性癌 | 4 | 31 | |
| 腺癌 | 3 | 11 | |
| 未成熟畸胎瘤 | 1 | 0 | |
| 透明细胞癌 | 1 | 4 | |
| 转移癌 | 0 | 5 | |
| 中分化Sertoli-Leydig细胞瘤 | 0 | 1 | |
| 其他 | 4 | 2 |
2.3 良恶性肿瘤的造影特征比较
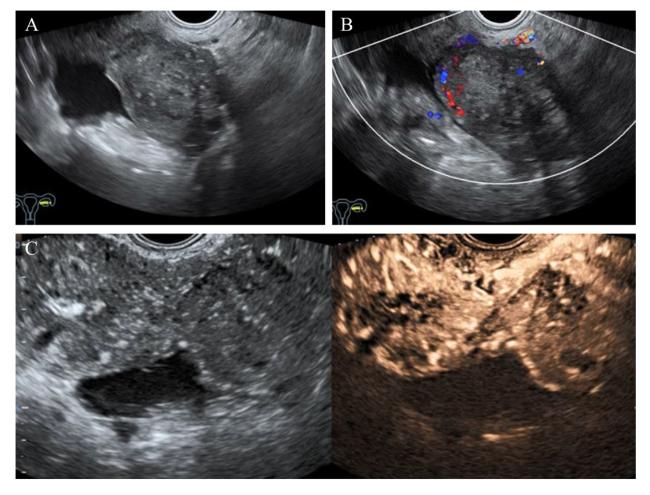
图2 左侧附件慢性化脓性炎症声像图注:A为灰阶超声检查图,于左侧附件区见一实性病灶,边缘光滑;B为同例患者彩色多普勒超声图,病灶内部可见少量血流信号(血流评分2分)。该病例被分为O-RADS 4类病变;C为同例患者CEUS图,表现为外周向中心逐渐增强,晚于子宫肌层增强,呈等增强。应用CEUS联合O-RADS诊断为良性病变。 Figure 2 Sonographic images of chronic suppurative inflammation in the left adnexal region |
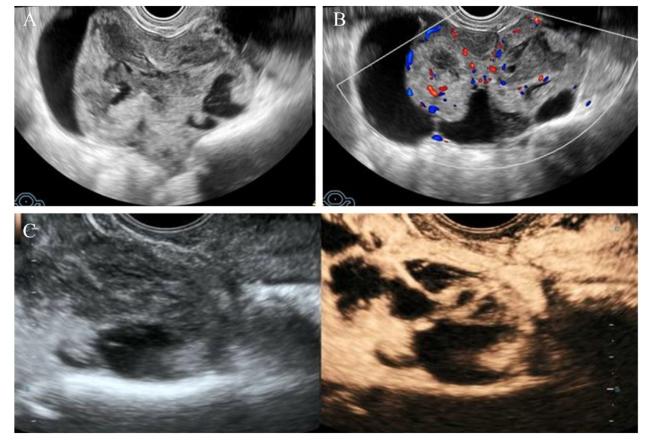
图3 右侧附件区高级别浆液性癌声像图注:A为灰阶超声图,示右侧附件区一个多房囊实病灶。内壁不规则,有多个乳头状突起;B为同例患者彩色多普勒超声图,示病灶内部可见较丰富血流信号(血流评分4分),该例被分为O-RADS 5类病变;C为同例患者CEUS图,表现为供血血管首先增强,呈不均匀增强,同步于子宫肌层,呈高增强。应用CEUS联合O-RADS诊断为恶性病变。 Figure 3 Sonographic images of high-grade serous carcinoma in the right adnexal region |
表5 232个卵巢-附件病灶的超声造影特征分析比较Table 5 Comparative analysis of contrast-enhanced ultrasound characteristics in 232 ovarian-adnexal lesions n(%) |
| 肿块 性质 | n | 增强形态 | 增强时间 | 增强水平 | 廓清模式 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不均匀 | 均匀 | 早增强 | 同步增强 | 迟增强 | 高增强 | 等增强 | 低增强 | 快速 | 同步 | 缓慢 | |||||
| 良性 | 132 | 36(27.3) | 96(72.7) | 15(11.4) | 23 (17.4) | 94(71.2) | 10 (7.6) | 65(49.2) | 57(43.2) | 58(43.9) | 50(37.9) | 24(18.2) | |||
| 恶性 | 100 | 66(66.0) | 34(34.0) | 51(51.0) | 19 (19.0) | 30(30.0) | 31(31.0) | 58(58.0) | 11(11.0) | 65(65.0) | 33(33.0) | 2 (2.0) | |||
| χ 2值 | 33.873 | 49.579 | 38.593 | 18.433 | |||||||||||
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |||||||||||
表6 良恶性肿块的TIC曲线相对造影参数比较Table 6 Comparison of relative contrast enhancement parameters in time-intensity curves between benign and malignant lesions |
| 相对造影参数 | 良性组 | 恶性组 | Z值 | P值 |
|---|---|---|---|---|
| AT | 1.300(-0.250,4.675) | -7.000(-12.000,0.960) | -5.591 | <0.001 |
| TTP | 1.095(-3.575,5.688) | -3.000(-6.450,0.080) | -4.879 | <0.001 |
| PI | -7.460(-16.730,-0.085) | 3.120(-5.430,8.280) | -5.721 | <0.001 |
| iAUC | -435.060(-1 006.995,-49.370) | 83.990(-376.000,546.510) | -5.792 | <0.001 |
2.4 CEUS、CEUS联合O-RADS对232个卵巢-附件病灶的诊断结果
表7 单独CEUS、CEUS联合O-RADS的诊断结果与病理结果对照Table 7 Comparison of diagnostic outcomes between CEUS alone and CEUS combined with O-RADS versus pathological results n(%) |
| 诊断方式 | 结果 | 病理结果 | 合计 | |
|---|---|---|---|---|
| 良性 | 恶性 | |||
| CEUS | 良性 | 105(83.3) | 21(16.7) | 126 |
| 恶性 | 27(25.5) | 79(74.5) | 106 | |
| CEUS联合O-RADS | 良性 | 109(90.8) | 11(9.2) | 160 |
| 恶性 | 23(20.5) | 89(79.5) | 72 | |
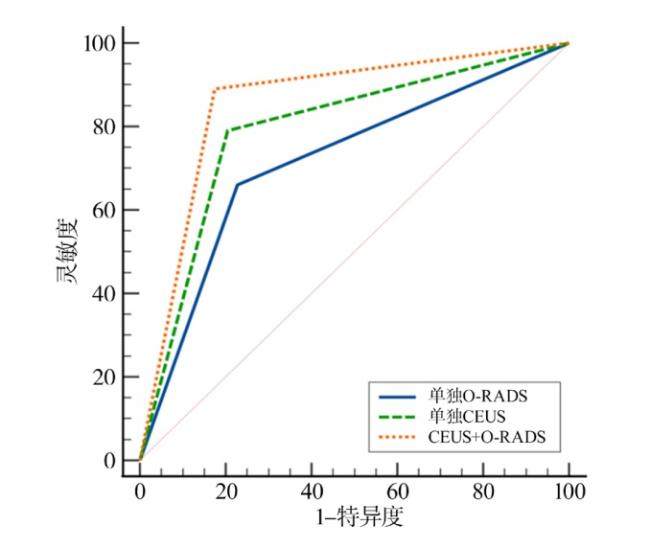
2.5 3种方法诊断效能的比较
表8 不同方法对O-RADS 4~5类肿块的诊断效能比较Table 8 Comparison of diagnostic efficacy among methods for O-RADS 4~5 lesions |
| 诊断方式 | AUC(95%CI) | 灵敏度 (95%CI)/% | 特异度 (95%CI)/% | 阳性预测值(95%CI)/% | 阴性预测值 (95%CI)/% |
|---|---|---|---|---|---|
| O-RADS | 0.716(0.654,0.773)a | 100.0(96.4,100.0) | 0(0,2.8) | 43.1(43.1,43.1) | 0(0,0) |
| CEUS | 0.793(0.735,0.843)a | 79.0(69.7,86.5) | 79.5(71.7,86.1) | 74.5(67.3,80.6) | 83.3(77.2,88.1) |
| CEUS联合 O-RADS | 0.858(0.806,0.900)ab | 89.0(81.2,94.4) | 82.6(75.0,88.6) | 79.5(72.6,85.0) | 90.8(85.0,94.6) |
注:与O-RADS组比较,aP < 0.05;与CEUS组比较,bP < 0.05。 |